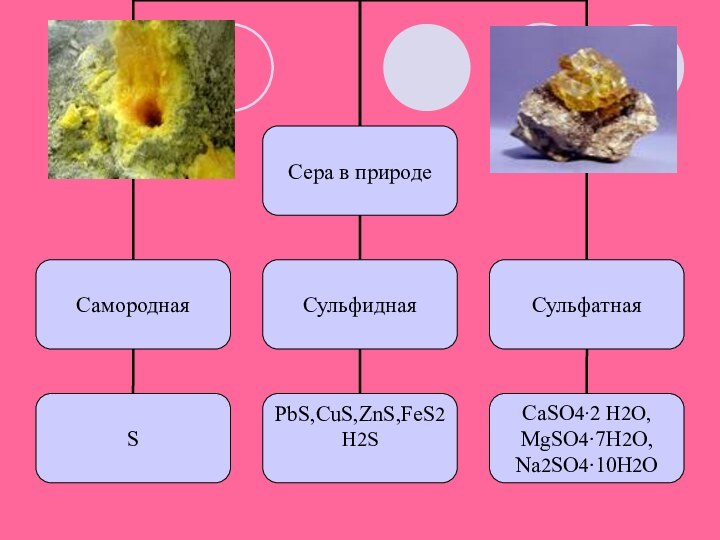
она в природе встречается в самородном виде. Считалось, что
голубое пламя и запах, распространяемый при горении серы, отгоняет демонов.Историческая справка
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть















Историческая справка
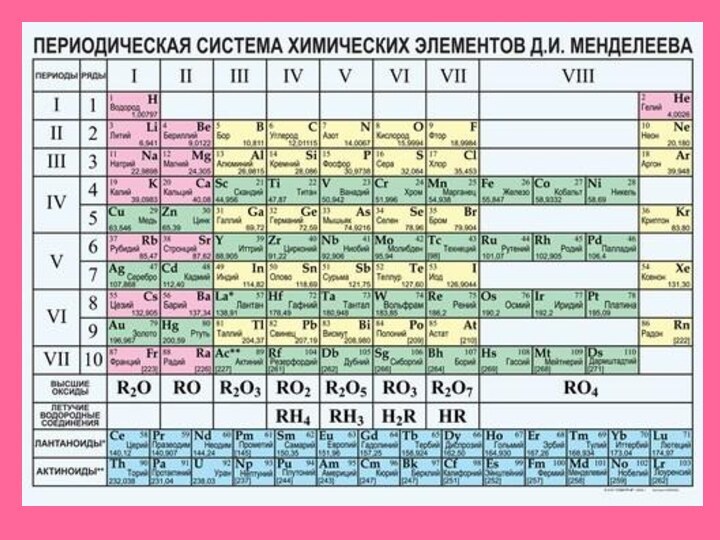
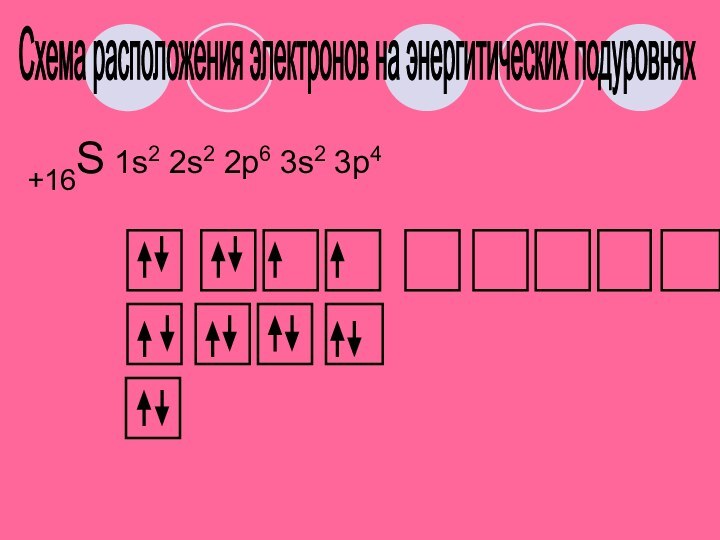
Характеристика серы по ПСХЭ
Получение
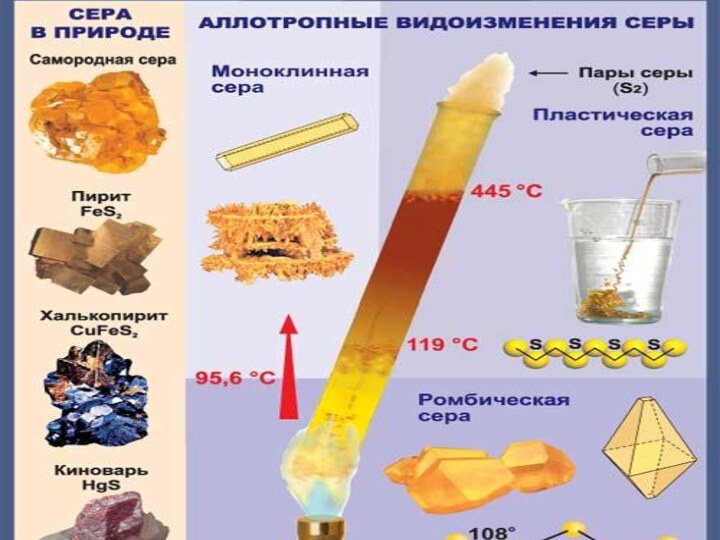
Физические свойства серы.
Применение серы
Химические свойства