( в переводе с греческого "атом"
означает " неделимый "). Этимология названия "неделимый" отражает сущность
атома с точностью до наоборот.
Атом – сложная частица.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть










Атом – сложная частица.
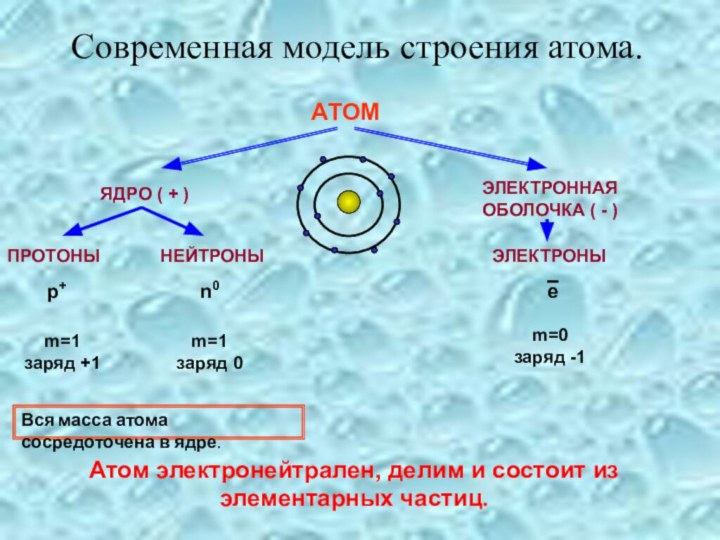
Планетарная модель Резерфорда.
Ядро – "Солнце".
Электроны – "планеты".
m=0 заряд -1
Вся масса атома сосредоточена в ядре.
Атом электронейтрален, делим и состоит из элементарных частиц.
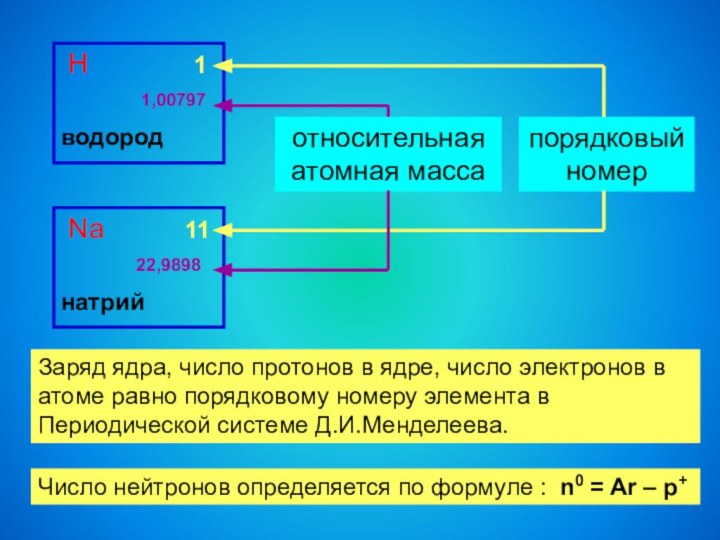
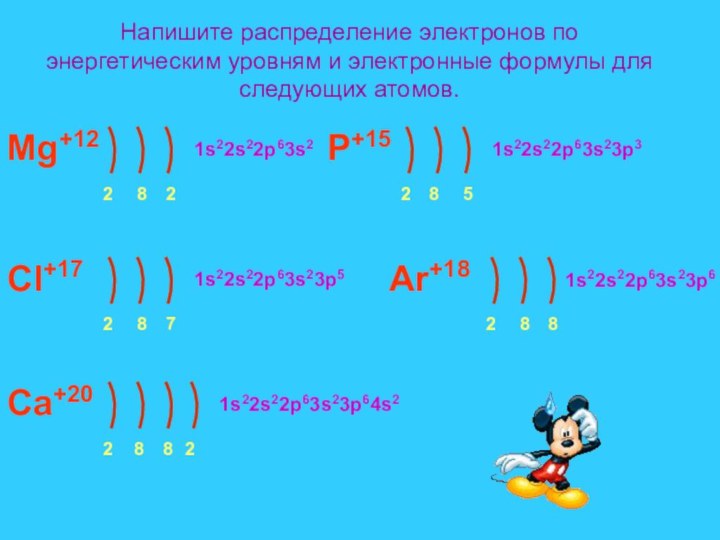
Na 11
22,9898
натрий
порядковый номер
относительная атомная масса
Заряд ядра, число протонов в ядре, число электронов в атоме равно порядковому номеру элемента в Периодической системе Д.И.Менделеева.
Число нейтронов определяется по формуле : n0 = Ar – p+
Al
p+
ē
n0
Br
p+
ē
n0
8
8
8
13
13
14
35
35
46
?
Что произойдет, если изменить число нейтронов в ядре ?
Ответ : это будет тот же химический элемент, но атомы его будут отличаться от исходных своей массой.
Образуются изотопы.
Н
Н
Н
1
1
2
1
3
1
Относительная атомная масса
Заряд ядра
+
энергетические уровни
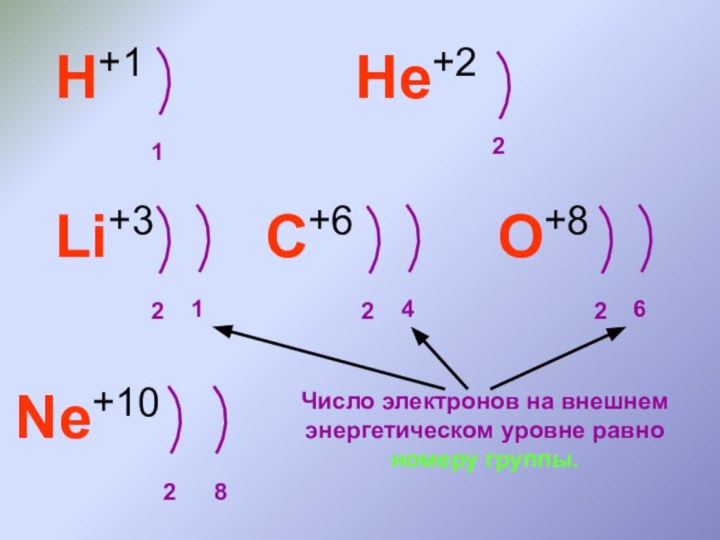
Число энергетических уровней в атоме определяется по номеру периода.
2ē
8ē
18ē
32ē
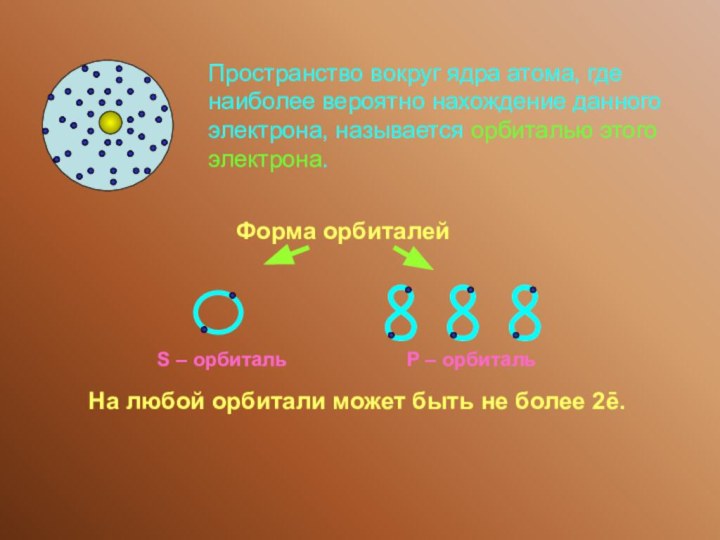
Максимальное число электронов, находящихся на энергетическом уровне, определяется по формуле:
2n2, где n – номер уровня.
На любой орбитали может быть не более 2ē.