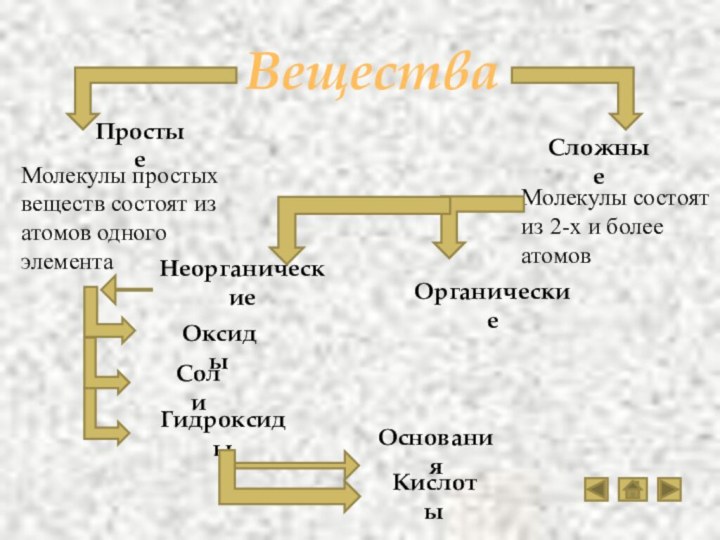
оснований
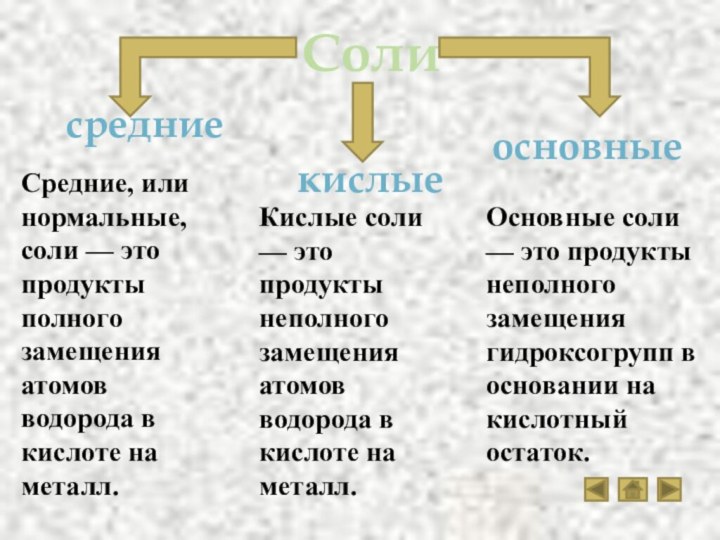
Соли
Разнообразие солей
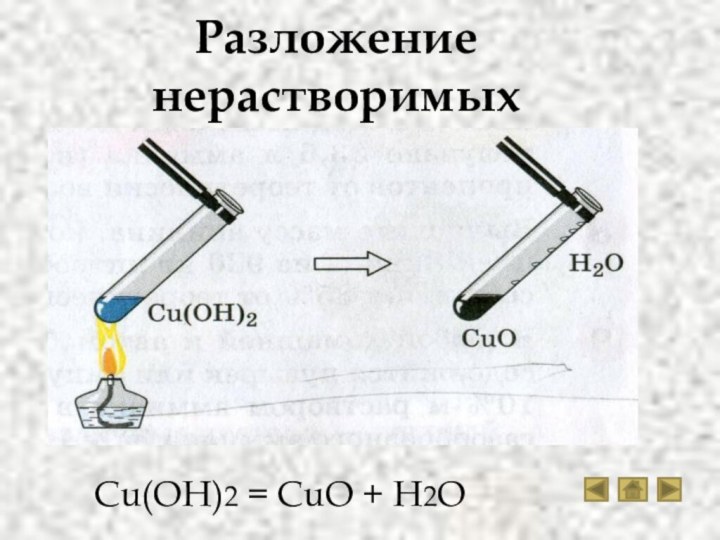
Свойства солей
Оксиды
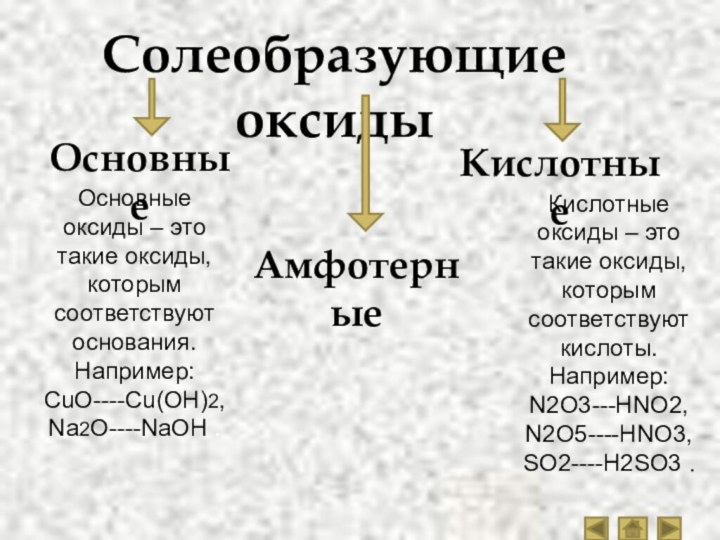
Солеобразующие оксиды
Типичные реакции основных оксидов
Типичные реакции кислотных
оксидовСодержание