- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме Окислительно-восстановительные реакции
Содержание
- 2. Химическое превращение, химическая реакция есть главный предмет химии.Лауреат Нобелевской премии Н.Н.Семенов
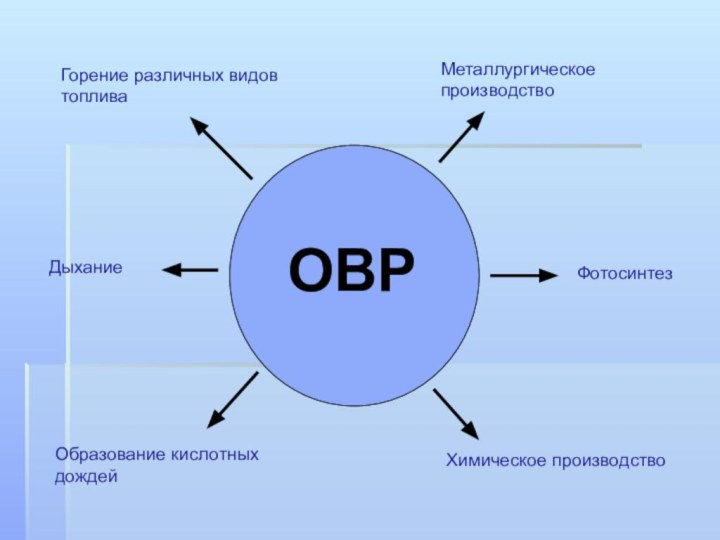
- 3. ОВРМеталлургическое производствоХимическое производствоОбразование кислотных дождейГорение различных видов топливаДыханиеФотосинтез
- 4. Цели:─ совершенствование умений выражать сущность окислительно-восстановительных реакций,
- 5. Пути реализации:─ знание опорных понятий теории окислительно-восстановительных
- 6. І. Определение степени окисления атомов химических элементов в заданных формулах.
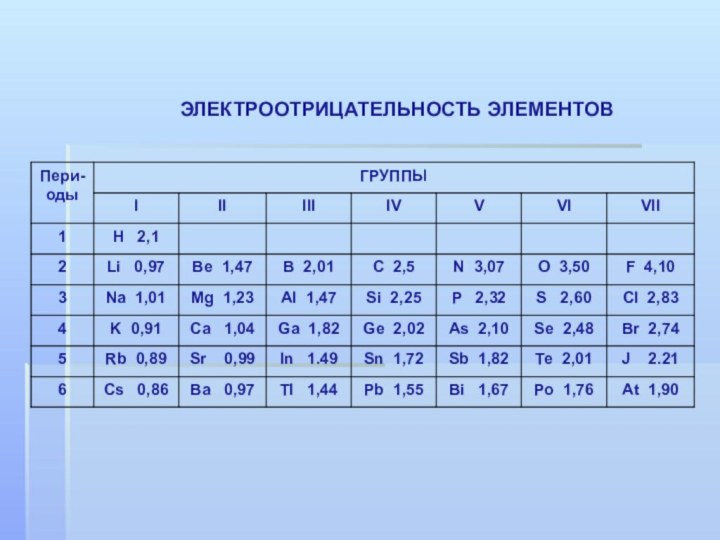
- 8. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ЭЛЕМЕНТОВ
- 9. ВЫЧИСЛЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В
- 10. АЛГОРИТМ II(в соединении отсутствует элемент с постоянной
- 11. ВЫЧИСЛЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ В СЛОЖНЫХ ИОНАХПОМНИТЬ:алгебраическая
- 12. ВЫЧИСЛЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ХИМИЧЕСКИХЬЭЛЕМЕНТОВ В МНОГОЭЛЕМЕНТНЫХ СОЕДИНЕНИЯХПОМНИТЬ:алгебраическая
- 13. ЗАДАНИЕ №1I ГРУППА1). Укажите, в каком случае
- 14. ЗАДАНИЕ №1I ГРУППА1). Укажите, в каком случае
- 15. ЗАДАНИЕ №1III ГРУППА1). Установите соответствие между формулой
- 16. ЗАДАНИЕ №1III ГРУППА1). Установите соответствие между формулой
- 17. ЗАДАНИЕ №1ІІ ГРУППА1). В соединениях PH3,
- 18. ЗАДАНИЕ №1IV ГРУППА 1). Установите соответствие между
- 19. Значение понятия «степень окисления»:1) степень окисления –
- 20. ІІ. Опорные понятия теории ОВР
- 21. ЗАДАНИЕ №2 ІІ ГРУППА 1) Из перечня
- 22. ЗАДАНИЕ №2 ІІ ГРУППА 1) Из перечня
- 23. 2) Укажите, какие из перечисленных ниже процессов
- 24. 2) Укажите, какие из перечисленных ниже процессов
- 25. III. Прогнозирование функции веществ в окислительно- восстановительных реакциях
- 26. Восстановитель
- 27. ЗАДАНИЕ №3 ІV ГРУППАУкажите, какие из приведенных
- 28. +2MnSO4 - проявляет и окислительные
- 29. IV. Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- 30. ПОМНИТЕ:общее число электронов, которые отдает восстановитель, должно
- 31. 4) Сбалансируйте число электронов между окислителем и
- 32. ЗАДАНИЕ №4ІІІ ГРУППАВыразите сущность приведенной ниже окислительно-восстановительной
- 33. +4
- 34. ЗАДАНИЕ №4І ГРУППАВыразите сущность приведенной ниже окислительно-восстановительной
- 35. ЗАДАНИЕ №4ІІ ГРУППАВыразите сущность приведенной ниже окислительно-восстановительной
- 36. ЗАДАНИЕ №4ІV ГРУППАВыразите сущность приведенной ниже окислительно-восстановительной
- 37. V. Прогнозирование протекания окислительно- восстановительной реакции
- 38. Какие продукты образуются при взаимодействии иодида калия
- 39. Скачать презентацию
- 40. Похожие презентации
Химическое превращение, химическая реакция есть главный предмет химии.Лауреат Нобелевской премии Н.Н.Семенов

































Слайд 2
Химическое превращение, химическая реакция есть главный предмет химии.
Лауреат
Нобелевской премии Н.Н.Семенов
Слайд 3
ОВР
Металлургическое производство
Химическое производство
Образование кислотных дождей
Горение различных видов топлива
Дыхание
Фотосинтез
Слайд 4
Цели:
─ совершенствование умений выражать сущность окислительно-восстановительных реакций, используя
метод электронного баланса;
─ прогнозирование протекания окислительно-восстановительных реакций;
─ подготовка в
рамках урока к сдаче ЕГЭ по химии.
Слайд 5
Пути реализации:
─ знание опорных понятий теории окислительно-восстановительных реакций;
─
умение определять степени окисления атомов химических элементов в заданных
формулах (в бинарных и многоэлементных соединениях, ионах);─ умение определять функции соединений в окислительно-восстановительных реакциях по степени окисления химических элементов.
Слайд 9 ВЫЧИСЛЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В БИНАРНЫХ
СОЕДИНЕНИЯХ
ПОМНИТЬ:
алгебраическая сумма степеней окисления атомов в химических соединениях
равна 0.АЛГОРИТМ I
(в соединении есть элемент, степень окисления которого постоянна)
1). Указать элемент, у которого степень окисления имеет постоянное значение
NaCl, Mg3N2
2). Над символом элемента записать значение степени окисления
+1 +2
NaCl, Mg3N2
3). Значение степени окисления умножить на число атомов данного элемента (т.е. на его индекс). Разделить полученное произведение на число атомов химического элемента (индекс), степень окисления которого неизвестна.
(+1)×1:1 = +1 (+2) × 3:2 = +3
4). Изменить знак полученного частного на противоположный. Это и будет значение степени окисления неизвестного элемента
+1 → –1 +3 → –3
+1 –1 +2 –3
NaCl, Mg3N2
Слайд 10
АЛГОРИТМ II
(в соединении отсутствует элемент с постоянной степенью
окисления)
1). Найти, какой из двух элементов в соединении является
более электроотрицательным.Над символом более электроотрицательного элемента поставить знак минус «─».
Над символом менее электроотрицательного элемента поставить знак плюс «+».
+ ─ + –
Fe2S3 SnCl4
2). Определить числовое значение степени окисления для более электроотрицательного элемента по формуле (8 – номер группы)
+ ─2 + –1
Fe2S3 SnCl4
3). Определить общее число «─» зарядов в соединении. Для этого степень окисления более электроотрицательного элемента умножаем на его индекс
(– 2) × 3 = – 6 (–1) × 4 = – 4
4). Найти степень окисления менее электроотрицательного элемента. Для этого общее число «+» зарядов разделить на индекс у данного элемента
+3 -2 +4 -1
Fe2S3 SnCl4
Слайд 11
ВЫЧИСЛЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ В СЛОЖНЫХ ИОНАХ
ПОМНИТЬ:
алгебраическая сумма
степеней окисления атомов равна заряду иона
АЛГОРИТМ
1). Обозначить
степень окисления неизвестного элемента через хx 2 – x 3–
( Cr2O7) ( PO4)
2). Умножить известное значение степени окисления кислорода (– 2) на число его атомов в ионе, составить уравнение и найти значение х
x 2 – x 3–
( Cr2O7) ( PO4)
2х + (–2)×7 = –2 х + (–2)×4 = –3
2х = +12 х = +5
Х = +6
3). Над символом элемента записать найденное значение степени окисления
+6 –2 2 – +5 –2 3–
(Cr2O7) (PO4)
Слайд 12
ВЫЧИСЛЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ХИМИЧЕСКИХЬЭЛЕМЕНТОВ В МНОГОЭЛЕМЕНТНЫХ СОЕДИНЕНИЯХ
ПОМНИТЬ:
алгебраическая сумма
степеней окисления атомов в химическом соединении равна 0.
Используется предыдущий
алгоритм+1 x –2 +3 x –2 x –2 +1
H2SO4 Al2(SO4)3 Fe(OH)3
(+1) ×2 + х + (–2)×4 = 0 (+3) ×2 + (х) ×3 + (–2)×4 ×3 = 0 х + (–2)×3 + (+1) ×3 = 0
х = +6 3х = +18 х = +3
х = +6
+1 +6 –2 +3 +6 –2 +3 –2 +1
H2SO4 Al2(SO4)3 Fe(OH)3
Слайд 13
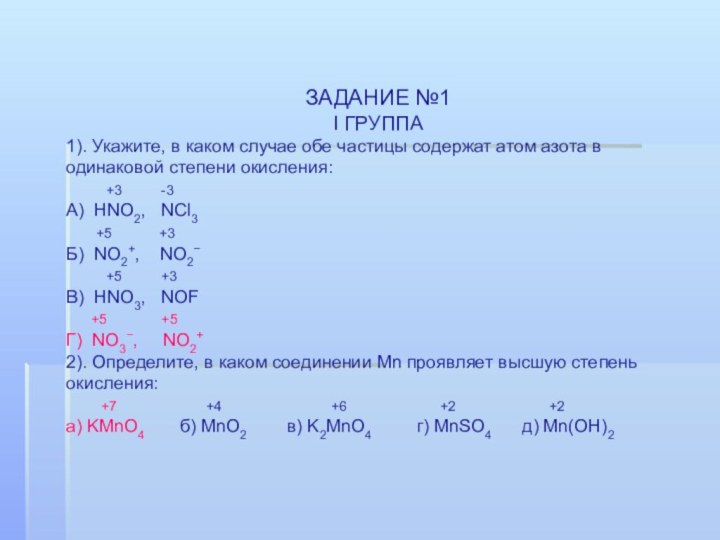
ЗАДАНИЕ №1
I ГРУППА
1). Укажите, в каком случае обе
частицы содержат атом азота в одинаковой степени окисления:
А) HNO2, NCl3
Б) NO2+, NO2−
В) HNO3, NOF
Г) NO3−, NO2+
2). Определите, в каком соединении Mn проявляет высшую степень окисления:
а) KMnO4 б) MnO2 в) K2MnO4 г) MnSO4 д) Mn(OH)2
Слайд 14
ЗАДАНИЕ №1
I ГРУППА
1). Укажите, в каком случае обе
частицы содержат атом азота в одинаковой степени окисления:
+3 -3А) HNO2, NCl3
+5 +3
Б) NO2+, NO2−
+5 +3
В) HNO3, NOF
+5 +5
Г) NO3−, NO2+
2). Определите, в каком соединении Mn проявляет высшую степень окисления:
+7 +4 +6 +2 +2
а) KMnO4 б) MnO2 в) K2MnO4 г) MnSO4 д) Mn(OH)2
Слайд 15
ЗАДАНИЕ №1
III ГРУППА
1). Установите соответствие между формулой иона
и степенью окисления металла в нем:
Формула иона
Степень окисления металла1) Mo2O72− а) +2 е) +7
2) MnO42− б) +3
3) [Al (H2O)6]3+ в) +4
4) [PtCl6]2– г) +5 д) +6
Слайд 16
ЗАДАНИЕ №1
III ГРУППА
1). Установите соответствие между формулой иона
и степенью окисления металла в нем:
Формула иона
Степень окисления металла1) Mo2O72− а) +2 е) +7
2) MnO42− б) +3
3) [Al (H2O)6]3+ в) +4
4) [PtCl6]2– г) +5 д) +6
Слайд 17
ЗАДАНИЕ №1
ІІ ГРУППА
1). В соединениях PH3, P2O5,
H3PO3
фосфор имеет степени окисления, соответственно равные:
а) +3, +5,
−3б) −3, +5, +3
в) −3, +3, +5
г) +3, −5, −3.
2). Степень окисления хлора
* в соединении Ca(ClO)2 равна а) +1, б) +3, в) +5, г) +7;
* в ионе СlO3− а) +1, б) +3, в) +5, г) +7;
* в соединении ClO2F3 а) +1, б) +3, в) +5, г) +7
Слайд 18
ЗАДАНИЕ №1
IV ГРУППА
1). Установите соответствие между химической
формулой соединения и степенью окисления фосфора в нем:
Химическая формула
Степень окисления фосфора1) H3PO3 А) +1 Д) –1
2) H3PO4 Б) +3
3) H3PO2 В) +5
4) H4P2O7 Г) –3
Слайд 19
Значение понятия «степень окисления»:
1) степень окисления – вспомогательная
величина для записи процессов окисления и восстановления и уравнений
окислительно-восстановительных реакций методом электронного баланса;2) по степени окисления удобно предсказывать функции веществ в ОВР.
Слайд 21
ЗАДАНИЕ №2
ІІ ГРУППА
1) Из перечня приведенных
уравнений химических реакций выберите уравнения окислительно-восстановительных реакций:
А) СаCО3 +
Н2О + CO2 = Са(НCO3)2Б) Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
B) 2NO2 + H2O = HNO2 + HNO3
Слайд 22
ЗАДАНИЕ №2
ІІ ГРУППА
1) Из перечня приведенных
уравнений химических реакций выберите уравнения окислительно-восстановительных реакций:
А) СаCО3 +
Н2О + CO2 = Са(НCO3)2Б) Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
+4 +3 +5
B) 2NO2 + H2O = HNO2 + HNO3 - ОВР
Слайд 23 2) Укажите, какие из перечисленных ниже процессов представляют
собой окисление, какие – восстановление?
Определите число отданных и принятых
электронов в каждом процессе:0 –2
1) Se → Se
+2 0
2) Cu → Cu
0 +3
3) Cr → Cr
0 +1
4) H2 → 2H
–2 0
5) 2O → O2
+6 +3
6) Cr → Cr
Слайд 24 2) Укажите, какие из перечисленных ниже процессов представляют
собой окисление, какие – восстановление?
Определите число отданных и принятых
электронов в каждом процессе:0 –2
1) Se +2е → Se - процесс восстановления
+2 0
2) Cu +2е → Cu - процесс восстановления
0 +3
3) Cr -3е → Cr - процесс окисления
0 +1
4) H2 -2е → 2H - процесс окисления
–2 0
5) 2O - 4е → O2 - процесс окисления
+6 +3
6) Cr +3е → Cr - процесс восстановления
Слайд 26
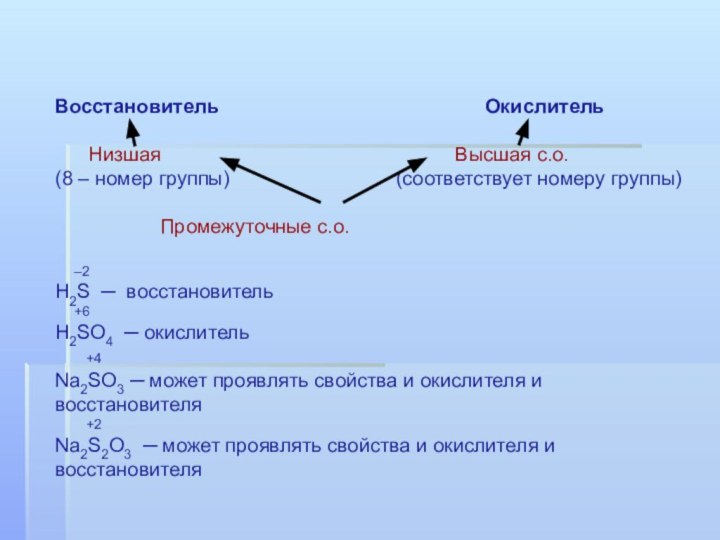
Восстановитель
Окислитель
Низшая Высшая с.о.
(8 – номер группы) (соответствует номеру группы)
Промежуточные с.о.
–2
H2S ─ восстановитель
+6
H2SO4 ─ окислитель
+4
Na2SO3 ─ может проявлять свойства и окислителя и восстановителя
+2
Na2S2O3 ─ может проявлять свойства и окислителя и восстановителя
Слайд 27
ЗАДАНИЕ №3
ІV ГРУППА
Укажите, какие из приведенных ниже
веществ могут проявлять (по элементу марганцу):
А) окислительные свойства
Б) восстановительные
свойстваВ) и окислительные и восстановительные свойства
MnSO4, Mn2O7, MnO2, Mn
Обоснуйте свой выбор.
Слайд 28
+2
MnSO4 - проявляет и окислительные и
восстановительные свойства
+7
Mn2O7 - проявляет окислительные свойства
+4
MnO2
- проявляет и окислительные и восстановительные свойства0
Mn - проявляет восстановительные свойства
Слайд 29 IV. Составление уравнений окислительно-восстановительных реакций методом электронного баланса
Слайд 30
ПОМНИТЕ:
общее число электронов, которые отдает восстановитель, должно быть
равно общему числу электронов, которые присоединяет окислитель.
АЛГОРИТМ
1). Запишите схему
реакции: формулы исходных веществ и продуктов реакцииCu + HNO3 → Cu(NO3)2 + NO + H2O
(р-р)
2). Определите степени окисления атомов химических элементов
0 +1+5 −2 +2 +5 −2 +2 –2 +1 −2
Cu + HNO3 → Cu(NO3)2 + NO + H2O
3). Составьте электронный баланс. Для этого запишите в две строки знаки химических элементов, атомы которых изменяют степени окисления, и укажите число отданных и принятых электронов
0 +2
восстановитель Cu – 2e → Cu - процесс окисления
+5 +2
окислитель N + 3e → N - процесс восстановления
Слайд 31 4) Сбалансируйте число электронов между окислителем и восстановителем,
т.е. найдите дополнительные множители, позволяющие уравнять число отданных и
принятых электронов, - это и будут коэффициенты0 +2
Cu – 2e → Cu 3
+5 +2
N + 3e → N 2
5) Перенесите эти коэффициенты в схему реакции. Подберите коэффициенты перед формулами других веществ реакции
3Cu +8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
6) Осуществите проверку (устно)
Слайд 32
ЗАДАНИЕ №4
ІІІ ГРУППА
Выразите сущность приведенной ниже окислительно-восстановительной реакции,
используя метод электронного баланса:
Na2SO3 + KIO3 + H2SO4
→ Na2SO4 + I2 + K2SO4 + H2OСлайд 33 +4
+5
+6 05Na2SO3 + 2KIO3 + H2SO4 → 5Na2SO4 + I2 + K2SO4 + H2O
+4 +6
восстановитель S – 2e → S 5 – процесс окисления
+5 0
окислитель 2I + 10e → I2 1 – процесс восстановления
Слайд 34
ЗАДАНИЕ №4
І ГРУППА
Выразите сущность приведенной ниже окислительно-восстановительной реакции,
используя метод электронного баланса:
-2
0 +4 -22H2S + 3O2 → 2SO2 + 2H2O
-2 +4
восстановитель S – 6e → S 2 – процесс окисления
0 -2
окислитель O2 + 4e → 2O 3 – процесс восстановления
Слайд 35
ЗАДАНИЕ №4
ІІ ГРУППА
Выразите сущность приведенной ниже окислительно-восстановительной реакции,
используя метод электронного баланса:
+4 +5 +6 +4Na2SO3 + 2HNO3 (к) → Na2SO4 + 2NO2 + H2O
+4 +6
восстановитель S – 2e → S 1 – процесс окисления
+5 +4
окислитель N + 1e → N 2 – процесс восстановления
Слайд 36
ЗАДАНИЕ №4
ІV ГРУППА
Выразите сущность приведенной ниже окислительно-восстановительной реакции,
используя метод электронного баланса:
0 +6 +2 -24Zn + 5H2SO4 (k) → 4ZnSO4 + H2S + 4H2O
+6 -2
окислитель S +8e → S 1 – процесс восстановления
0 +2
восстановитель Zn -2e → Zn 4 – процесс окисления
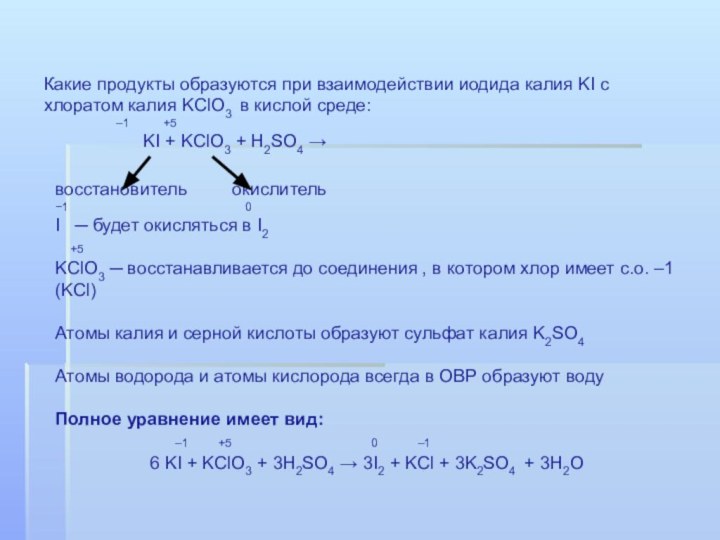
Слайд 38 Какие продукты образуются при взаимодействии иодида калия KI
с хлоратом калия KClO3 в кислой среде:
–1 +5KI + KClO3 + H2SO4 →
восстановитель окислитель
−1 0
I ─ будет окисляться в I2
+5
KClO3 ─ восстанавливается до соединения , в котором хлор имеет с.о. –1 (KCl)
Атомы калия и серной кислоты образуют сульфат калия K2SO4
Атомы водорода и атомы кислорода всегда в ОВР образуют воду
Полное уравнение имеет вид:
–1 +5 0 –1
6 KI + KClO3 + 3H2SO4 → 3I2 + KCl + 3K2SO4 + 3H2O