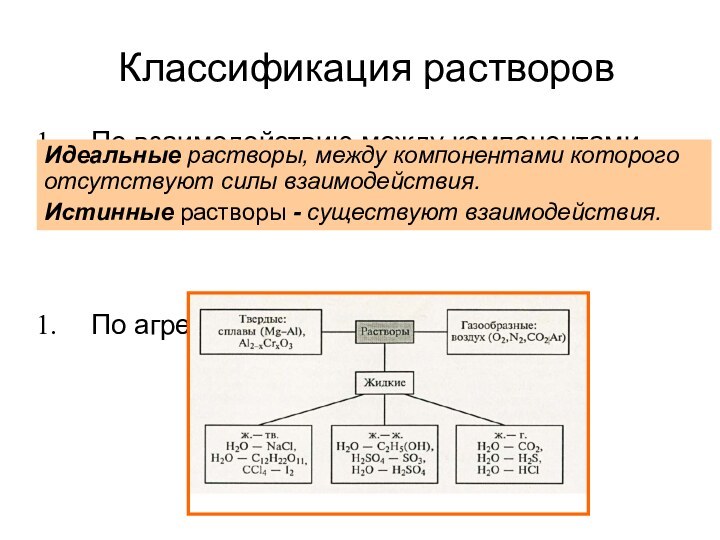
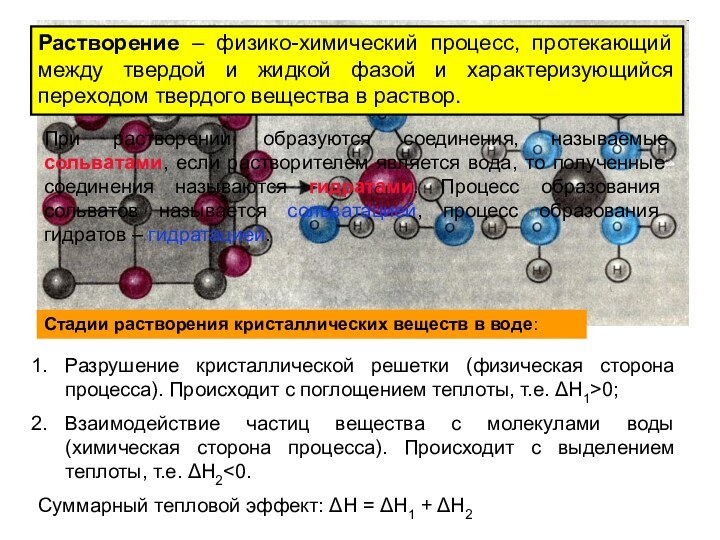
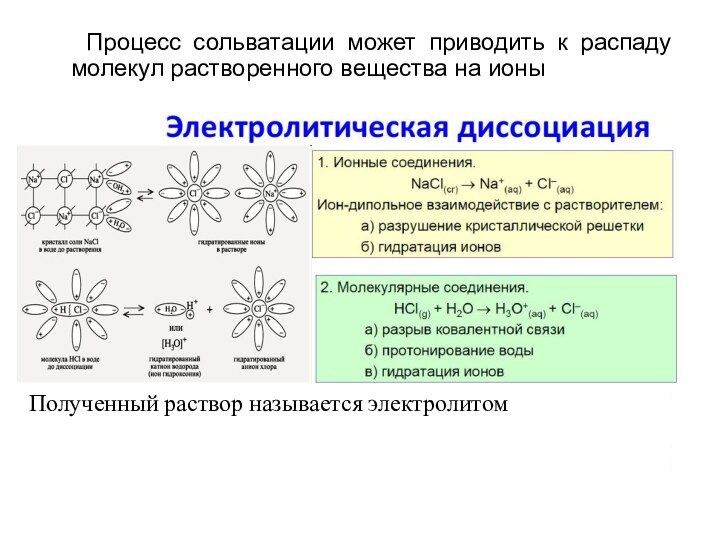
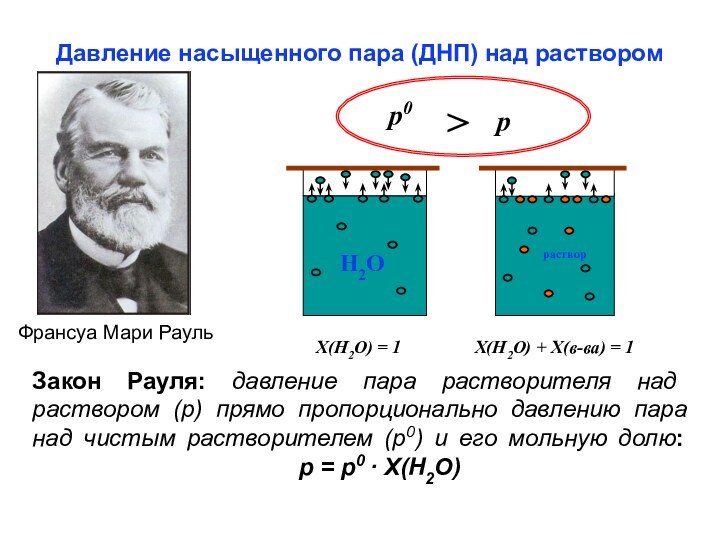
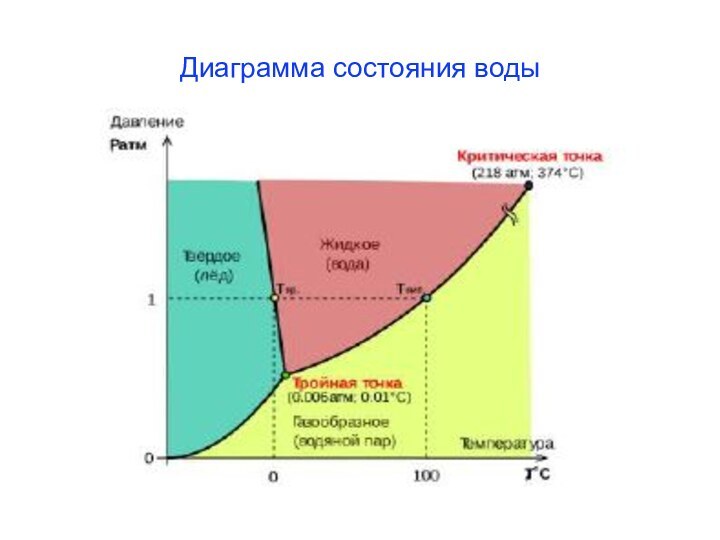
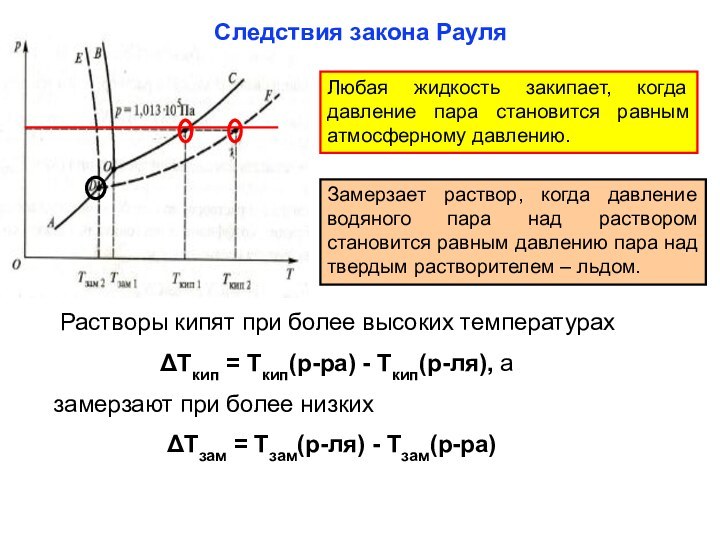
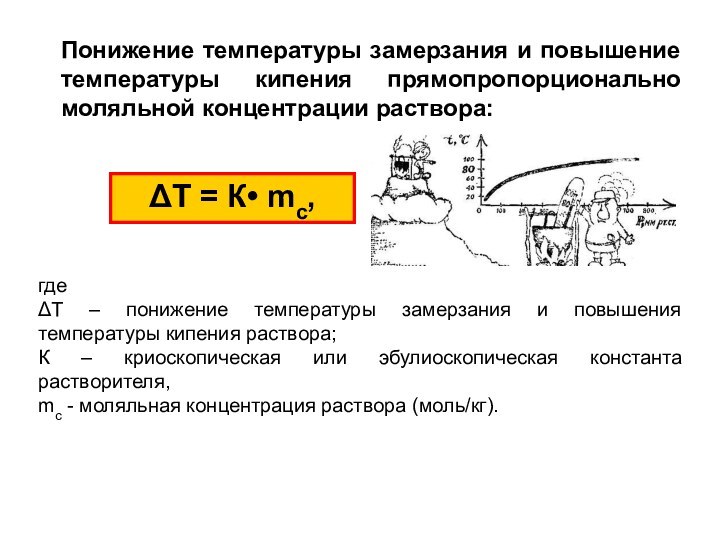
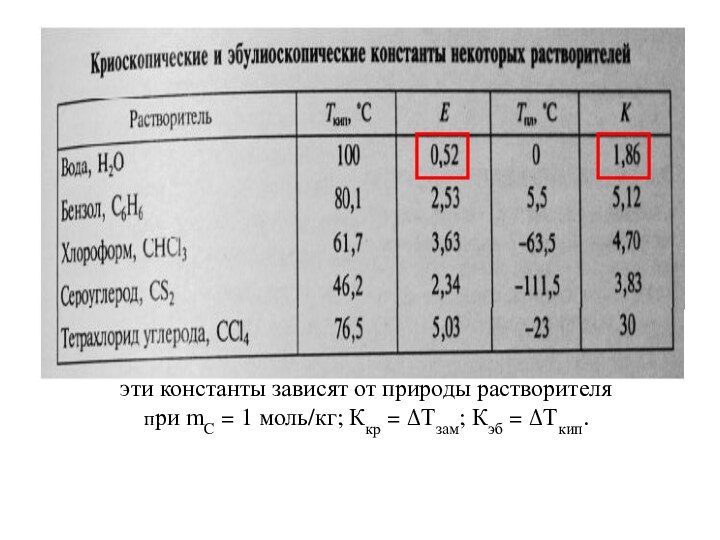
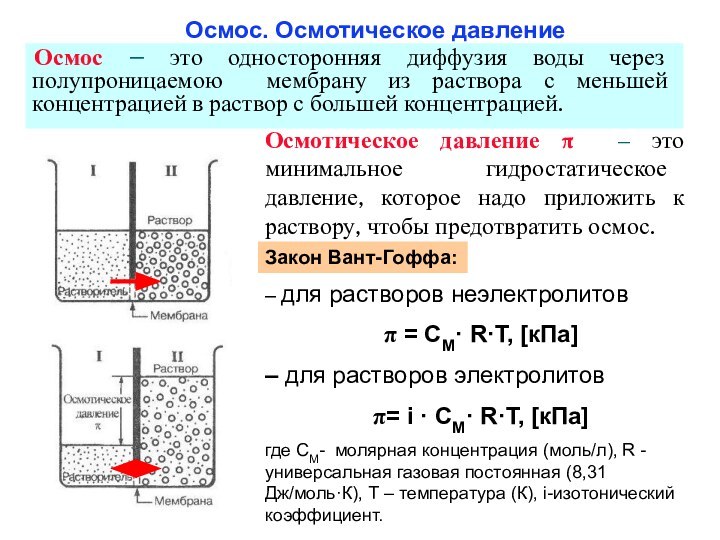
из двух и более компонентов.
Компоненты раствора
Растворитель
Растворенное вещество
Компонент, агрегатное состояние
которого не изменяется при образовании раствора, а при одинаковом агрегатном состоянии компонентов находится в избытке.вещество, равномерно распределенное в растворителе в виде молекул или ионов