- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Протекание химических реакций
Содержание
- 2. Первый закон термодинамики – закон сохранения энергииЭнергия
- 3. Энергия объектаКинетическая Потенциальная
- 4. Е реагентов > Е продуктовЭнергия выделяется в
- 5. Е реагентов < Е продуктовЭнергия поглощается из
- 6. Энергия, которая выделяется или поглощается в химической
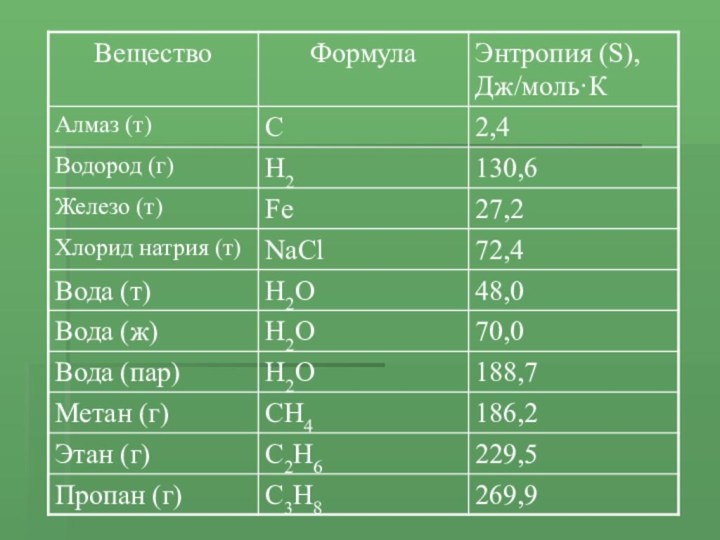
- 7. Для расчета тепловых эффектов реакций используют значения
- 8. Закон Гесса (1840)Тепловой эффект химической реакции не
- 9. Следствие из закона ГессаТепловой эффект химической реакции
- 10. Fe2O3 + 2Al = 2Fe + Al2O3
- 11. Энтальпия (теплосодержание) – это величина, которая характеризует
- 12. Движущая сила реакцийДля экзотермических реакций – стремление
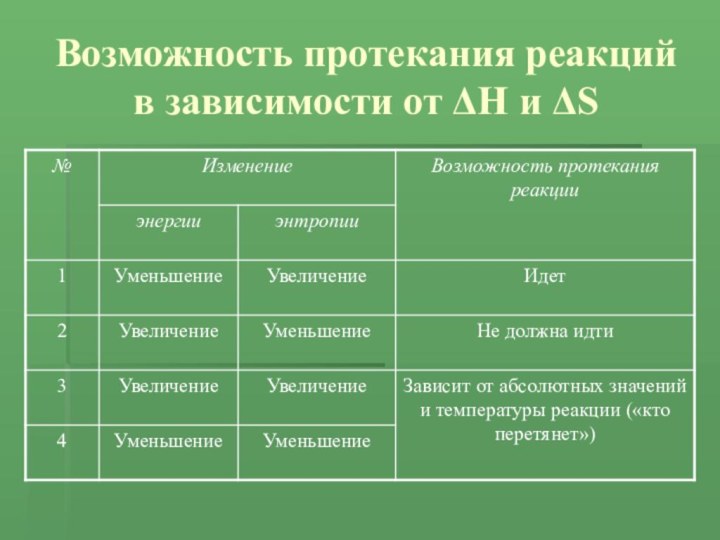
- 14. ВыводыНаправление химической реакции определяется двумя факторами: стремлением
- 15. Возможность протекания реакций в зависимости от ΔH и ΔS
- 16. Энергия Гиббса (G)ΔG = ΔH – TΔST
- 17. Задача 1. Определите количество теплоты, которое выделится
- 18. Задача 2. В результате реакции, термохимическое уравнение
- 19. Задача 3. В результате горения 48 г
- 20. Задача 4. Какой объем кислорода (при н.у.)
- 21. Согласно термохимическому уравнению реакции CH4+
- 22. Тепловой эффект реакции горения серы равен 297
- 23. По термохимическому уравнению H2+ Cl2
- 24. По термохимическому уравнению реакции СО2
- 25. По термохимическому уравнению реакции С2Н4
- 26. Скачать презентацию
- 27. Похожие презентации








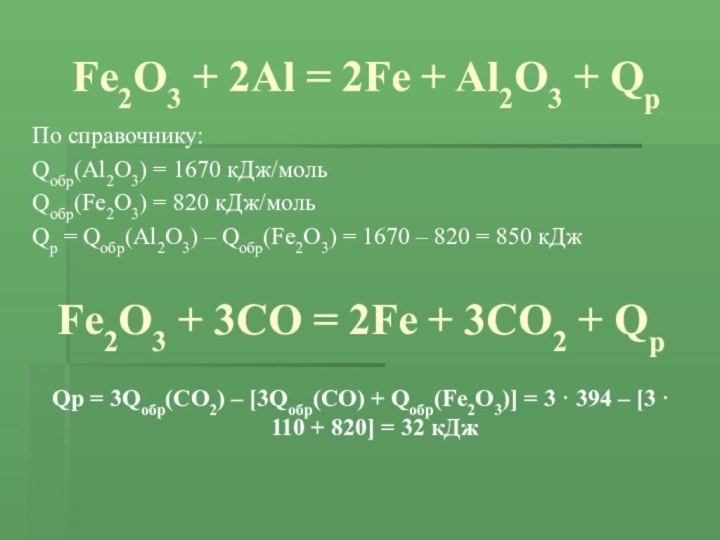














Слайд 3
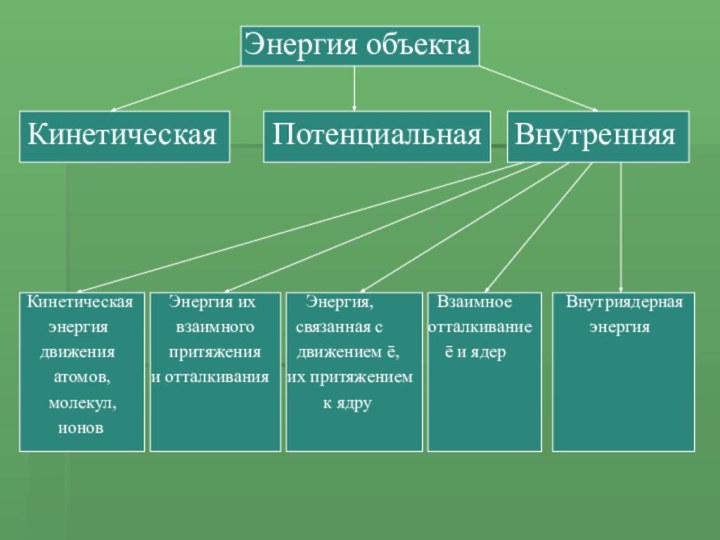
Энергия объекта
Кинетическая Потенциальная Внутренняя
Кинетическая Энергия их
Энергия, Взаимное Внутриядернаяэнергия взаимного связанная с отталкивание энергия
движения притяжения движением ē, ē и ядер
атомов, и отталкивания их притяжением
молекул, к ядру
ионов
Слайд 4
Е реагентов > Е продуктов
Энергия выделяется в окружающую
среду
Реакции, при которых выделяется энергия и нагревается окружающая среда,
называются экзотермическими.
Слайд 5
Е реагентов < Е продуктов
Энергия поглощается из окружающей
среды, температура системы понижается
Реакции, при протекании которых энергия поглощается
из окружающей среды, называется эндотермической.Слайд 6 Энергия, которая выделяется или поглощается в химической реакции,
называется тепловым эффектом реакции.
Тепловой эффект реакции
выражается в кДж
и его относят к тем количествам веществ, которые определены уравнением.Уравнение, в котором указан тепловой эффект реакции, называется термохимическим.
2H2 + O2 = 2H2O + 484 кДж
Слайд 7 Для расчета тепловых эффектов реакций используют значения величин
теплот образования исходных веществ и продуктов реакции
Теплота образования соединения
(Qобр) – это тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых в стандартных условиях (25°С, 1 атм)При таких условиях теплота образования простых веществ равна 0.
C + O2 = CO2 + 394 кДж
теплоты образования
0,5N2 + 0,5O2 = NO – 90 кДж
Слайд 8
Закон Гесса (1840)
Тепловой эффект химической реакции не зависит
от промежуточных стадий (при условии, что исходные вещества и
продукты реакции одинаковы).С + O2 → CO2 + 394 кДж/моль (Q1)
а) С + 0,5O2 → CO + ?(Q2)
б) CO + 0,5O2 → CO2 + 284 кДж/моль(Q3)
Q1 = Q2 + Q3
Q2 = Q1 – Q3 = 394 – 284 = 110 кДж
Слайд 9
Следствие из закона Гесса
Тепловой эффект химической реакции равен
сумме теплот образования всех продуктов реакции минус сумма теплот
образования всех реагентов (с учетом коэффициентов в уравнении реакции):Qр = ΣQобр(продукты) – ΣQобр(реагенты)
Слайд 10 Fe2O3 + 2Al = 2Fe + Al2O3 +
Qр
По справочнику:
Qобр(Al2O3) = 1670 кДж/моль
Qобр(Fe2O3) = 820 кДж/моль
Qр
= Qобр(Al2O3) – Qобр(Fe2O3) = 1670 – 820 = 850 кДжFe2O3 + 3CO = 2Fe + 3CO2 + Qр
Qр = 3Qобр(CO2) – [3Qобр(CO) + Qобр(Fe2O3)] = 3 · 394 – [3 · 110 + 820] = 32 кДж
Слайд 11 Энтальпия (теплосодержание) – это величина, которая характеризует запас
энергии в веществе.
ΔH = ΣHпродукты – ΣHреагенты
ΔH = -Qреакции
Для
экзотермической реакции:Q > 0, ΔH < 0
Для эндотермической реакции
Q < 0, ΔH > 0
(ΔH обр – справочное значение)
Слайд 12
Движущая сила реакций
Для экзотермических реакций – стремление системы
к состоянию с наименьшей внутренней энергией.
Для эндотермических реакций –
стремление любой системы в наиболее вероятному состоянию, которое характеризуется максимальным беспорядком, более высокой энтропией.Энтропия – мера хаоса.
Слайд 14
Выводы
Направление химической реакции определяется двумя факторами: стремлением к
уменьшению внутренней энергии и стремлением к увеличению энтропии.
Эндотермическую реакцию
можно активировать, если она сопровождается увеличением энтропии.Энтропия увеличивается при повышении температуры и особенно при фазовых переходах.
Чем выше температура, при которой проводят реакцию, тем большее значение будет иметь энтропийный фактор по сравнению по сравнению с энергетическим.
Слайд 16
Энергия Гиббса (G)
ΔG = ΔH – TΔS
T –
абсолютная температура
ΔH – изменение энтальпии системы
ΔS – изменение энтропии
системы Самопроизвольно протекают лишь те процессы, в которых энергия Гиббса уменьшается
ΔG < 0
Процессы, при которых ΔG > 0 – невозможны.
Если ΔG = 0, то есть ΔH = TΔS, значит в системе установилось равновесие.
Слайд 17 Задача 1. Определите количество теплоты, которое выделится при
образовании 120 г MgO в результате реакции горения магния,
с помощью термохимического уравнения. 2 Mq + O2 = 2MqO + 1204 кДжДано:
m (Mg0) = 120г
Найти:
Q1 -?
Решение:
n=m/М
n(MgO) = 120г/40г/моль=3моль
2 моль - 1204 кДж
3 моль – Х кДж
Х=1803 кДж
Слайд 18 Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж выделилось
652,5 кДж теплоты. Определите массу сгоревшего ацетилена.Дано:
Q1 = 652,5 кДж
Найти:
m(C2H2)-?
Решение:
2 моль – 2610 кДж
х моль – 652,5 кДж
Х = 0,5 моль
m = M * n
m = 0,5 моль * 26 г/моль = 13 г
Слайд 19 Задача 3. В результате горения 48 г метана
выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Дано:
m(CH4)=
48гQ1 = 2406 кДж
Найти:
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n = m / M
n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 - 2406 кДж
По уравнению 1 моль CH4 - Q
Решаем пропорцию
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Слайд 20 Задача 4. Какой объем кислорода (при н.у.) выделится
в результате реакции, термохимическое уравнение которой 2KClO3 = 2KCl
+ 3O2 – 91 кДж, если на разложение бертолетовой соли было затрачено 182 кДж теплоты.Дано:
Q1 = 91 кДж
Найти:
V (O2)-?
Решение:
1)Установим пропорциональные отношения между количеством вещества кислорода и количеством теплоты.
По уравнению 3 моль O2 ---------- 91 кДж
По условию х моль ---------- 182 кДж
Решаем пропорцию
2) Вычислим объем кислорода, согласно закону Авогадро
(Vm = 22б4 л.моль) V = n * Vm
V(O2) = 6 моль * 22,4 л/моль = 134,4 л