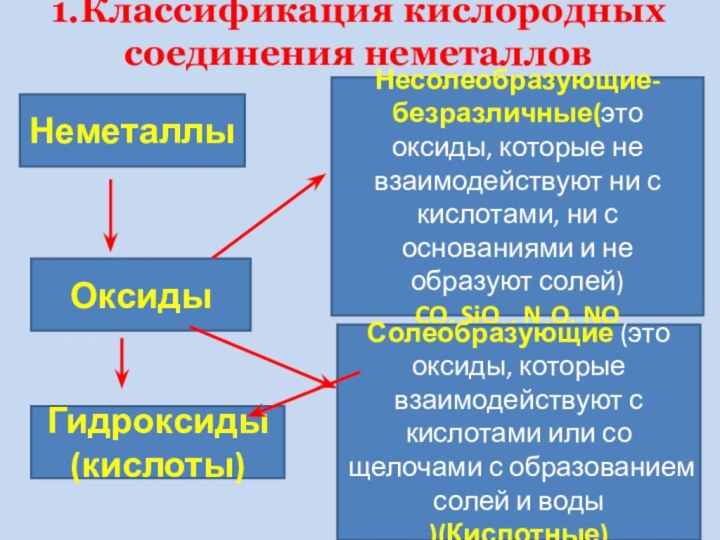
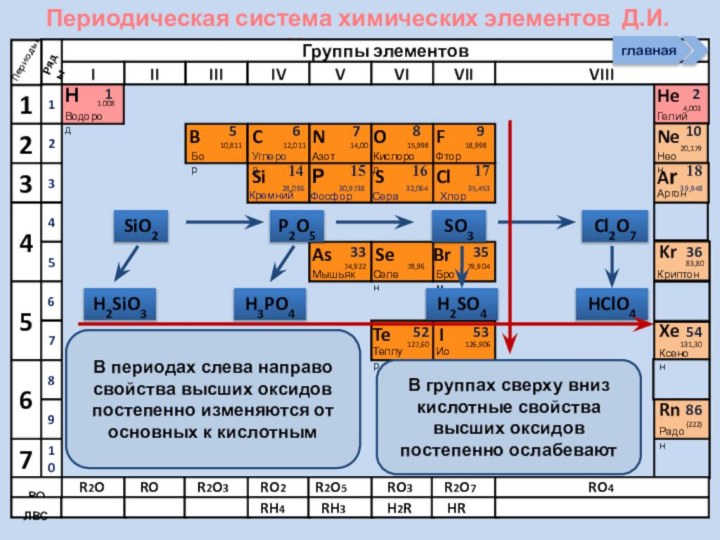
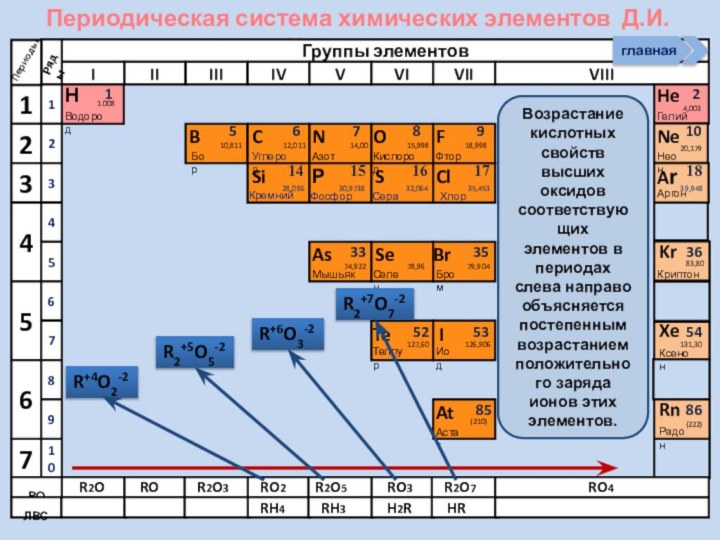
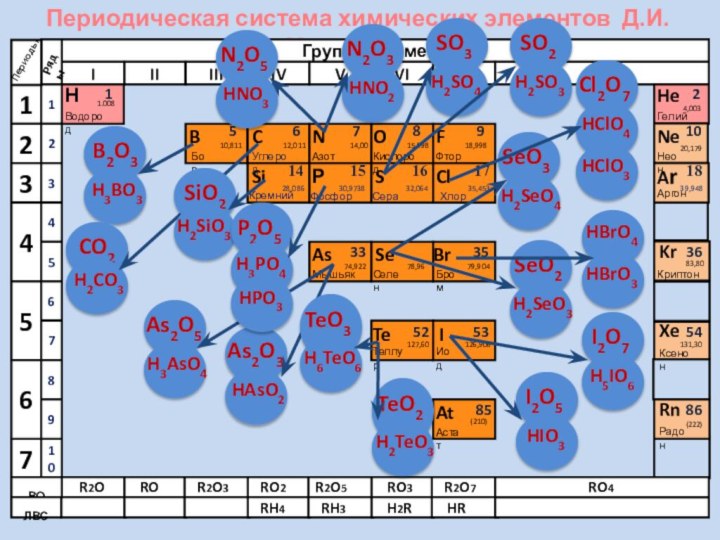
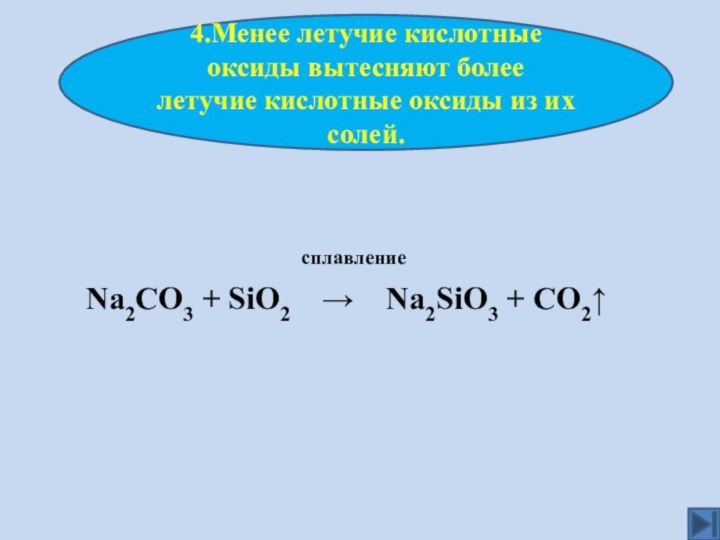
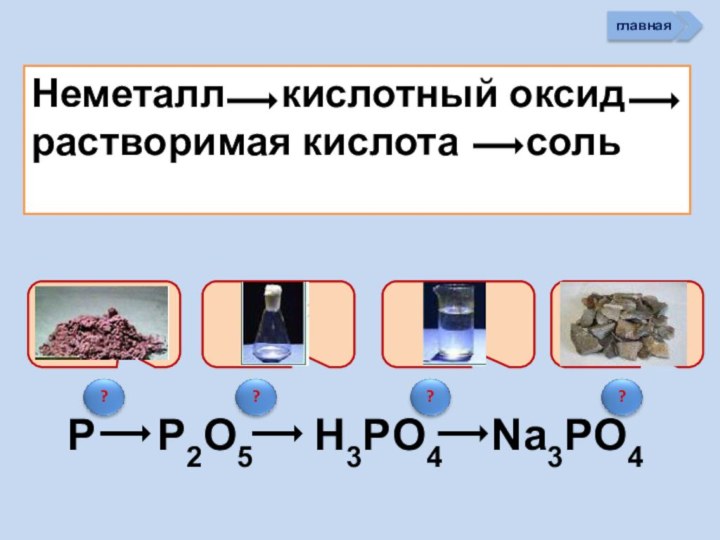
активности оксидов НеМе
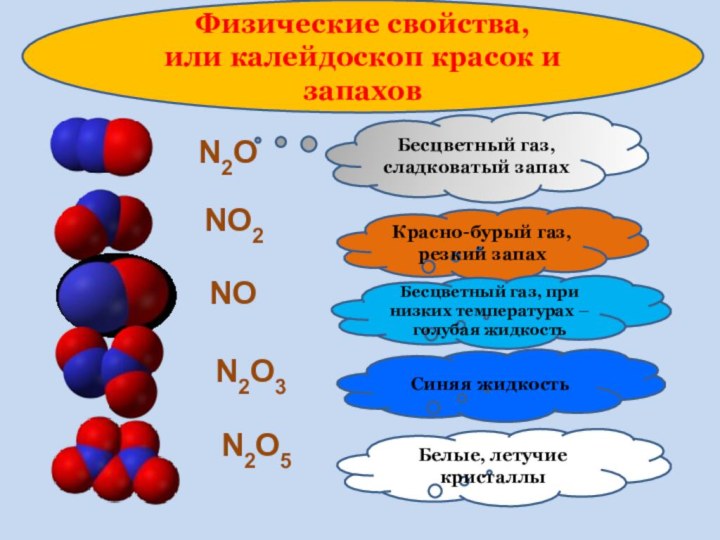
3.Рассматривать физические св-ва НеМеО
4. Рассматривать способы получения
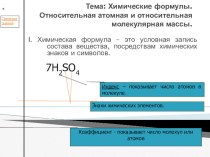
НеМеО5.Писать уравнения реакций характеризующих хим. св-ва оксидов НеМе
6.Осуществлять рефлексию учебной деятельности
В результате изучения темы ,вы будете способны: