Слайд 2
Цели урока:
научить составлять формулы оксидов и гидроксидов
металлов, сравнивать их свойства, учитывая положение в ПСХЭ Д.
И. Менделеева, степени окисления и радиусы ионов; закрепить знания особенностей свойств оксидов и гидроксидов, образованных металлами побочных подгрупп( на примере оксидов марганца и хрома).
Основные понятия: оксиды, гидроксиды, амфотерность оксида, амфотерность гидроксида.,
кислотность оксида , кислотность гидроксида.
Слайд 3
Окси́ды ма́рганца
Окси́ды ма́рганца — химические соединения марганца и кислорода с общей формулой MnxOy (кроме пероксидов
марганца).
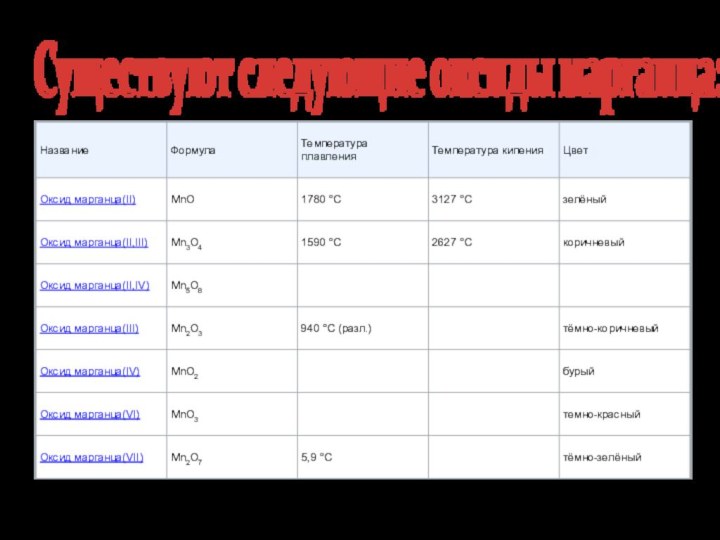
Существуют следующие оксиды марганца:
Слайд 4
Существуют следующие оксиды марганца:
Слайд 6
Соединения марганца (II).
Оксид и гидроксид марганца (II) проявляют
только основные свойства. Они нерастворимы в воде, но легко
растворяются в кислотах с образованием солей двухвалентного марганца.
Слайд 8
Получение
можно получить восстановлением оксида марганца (IV) в токе
водорода:
MnO2+Н2=MnO+Н2О
Слайд 9
Получение
Реакция взаимодействия оксида марганца(IV) и оксида углерода(II) с
образованием оксида марганца(II) и оксида углерода(IV). Реакция протекает при
комнатной температуре. Катализатором может выступать оксид меди(II).
Реакция взаимодействия оксида марганца(IV) и оксида углерода(II)
MnO2 + CO → MnO + CO2
Слайд 10
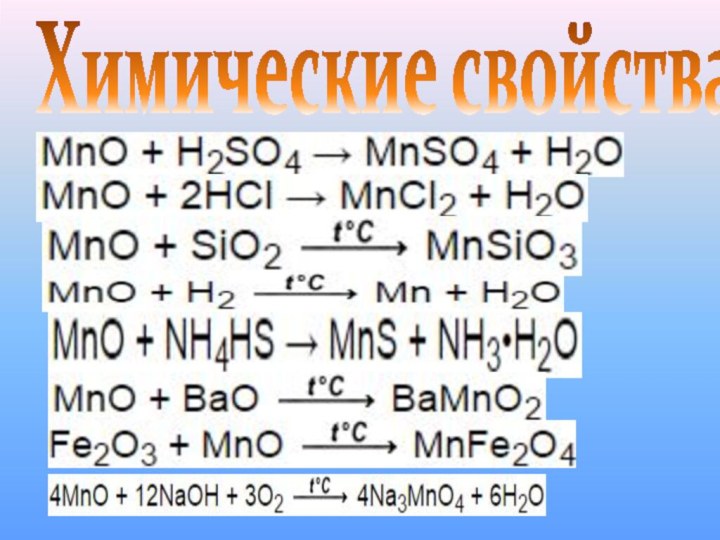
Химические свойства
MnO + BaO BaMnO2
Слайд 12
Химические свойства
Гидроксид марганца (II) обладает основными свойствами.
Перечислите свойства характерные для оснований Составьте уравнения реакций гидрооксида
марганца (II) с оксидом серы (VI), соляной кислотой:
Mn(OH)2 + SO3 = MnSO4
Mn(OH)2 + 2HCl = MnCl2 + 2H2O
Mn(OH)2 + 2H+ = Mn2+ + 2H2O
Слайд 13
Химические свойства
Реакция термического разложения гидроксида марганца(II) с образованием
оксида марганца(II) и воды. Реакция протекает при температуре 220-800°C,
в атмосфере азота
Mn(OH)2 MnO + H2O
Слайд 14
Химические свойства
Реакция взаимодействия гидроксида марганца(II) и пероксида водорода
Mn(OH)2 +
H2O2 → MnO2 + 2H2O
Реакция взаимодействия гидроксида марганца(II) кислорода и воды
2Mn(OH)2 +
O2 + 2H2O → 2Mn(OH)4
Слайд 15
Химическтие свойства
Реакция взаимодействия гидроксида марганца(II) и кислорода
2Mn(OH)2 + O2
2 MnO2 + 2H2O
Слайд 16
Оксид марганца(III)
Оксид марганца(III) — неорганическое соединение, оксид металла марганца с формулой Mn2O3,
коричнево-чёрные кристаллы, не растворимые в воде.
Слайд 17
Получение
В природе встречаются минералы браунит, курнакит и биксбиит — оксид марганца с различными
примесями.
Окисление оксида марганца(II):
4 MnO+O2=2Mn2O3
Восстановление оксида марганца(IV):
2MnO2+H2=Mn2O3+H2O
Слайд 18
Химические свойства
Разлагается при нагревании:
6Mn2O3
4Mn3O4+O2(t=950-1100)
Восстанавливается водородом:
Mn2O3+H2=2MnO+H2O (t=300)
При растворении в кислотах — диспропорционирует:
Mn2O3+H2SO4=MnO2+MnSO4+H2O
При сплавлении
с оксидами металлов образует соли манганиты:
Mn2O3+ZnO=ZnMn2O4
Слайд 19
Гидроксид марганца (III) –
Mn(OH)3 – гидроксид Mn3+- амфотерное соединение,
с преобладанием основных свойств:
Mn(OH)3 ↔ HMnO2
Слайд 20
Оксид марганца(IV)
Оксид марганца(IV) (диоксид марганца) MnO2 — порошок тёмно-коричневого
цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко
распространённое в земной коре (минерал пиролюзит), обладает амфотерными свойствами, с преобладанием кислотных свойств
Слайд 21
Получение
В лабораторных условиях получают термическим разложением перманганата калия
2KMnO4 → MnO2 + K2MnO4 + O2↑
Также можно
получить реакцией перманганата калия с пероксидом водорода. 2KMnO4 + H2O2 = 2KOH + 2MnO2 + 2O2
При температуре выше 100 °C перманганат калия восстанавливается водородом:
2KMnO4 + 2H2 = K2MnO4 + MnO2 + 2H2O Получение диоксида марганца t° опыт
Слайд 22
Химические свойства
Химические свойства диоксида марганца Диоксид марганца проявляет
амфотерные свойства и поэтому сплавляется с щелочами, образуя манганиты,
если реакция проводится без доступа воздуха:
MnO2 + 2KOH = K2MnO3 + H2O
Если реакция проводится в присутствии кисло- рода воздуха, который играет роль окислителя, то образуется манганат:
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O Полученный манганат самопроизвольно разлагается и образует перманганат калия и оксид марганца(IV):
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
Слайд 23
Химические свойства
При взаимодействии MnO2 с концентрированной серной кислотой образуется сульфат
марганца MnSO4 и выделяется кислород:
2Mn(OH)4 + 2H2SO4 = 2MnSO4 + O2 + 6H2O
Взаимодействие MnO2 с более сильными
окислителями приводит к образованию соединений марганца (VI) и (VII), например при сплавлении с хлоратом калия образуется манганат калия:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
а при действии диоксида полония в присутствии азотной кислоты – марганцевая кислота:
2MnO2 + 3PoO2 + 6HNO3 = 2HMnO4 + 3Po(NO3)2 + 2H2O
Слайд 24
Гидроксид марганца (IV)
Mn(OH)4 проявляет амфотерные свойства
Получение
На воздухе Mn(OH)2 окисляется, превращаясь
в гидроксид марганца (IV) Mn(OH)4 бурого цвета:
2Mn(OH)2 + O2 + 2H2O =
2Mn(OH)4
Слайд 25
Химические свойства
Легко теряет воду с образованием марганцовистой кислоты:
H4MnO4 =
H2MnO3 + H2O
Слайд 26
Оксид марганца(VI).
Оксид марганца(VI) — неорганическое соединение, оксид металла марганца с формулой MnO3, тёмно-красное
аморфное вещество, реагирует с водой.
Слайд 27
Получение
Образуется при конденсации фиолетовых паров, выделяемых при нагревании
раствора перманганата калияв серной кислоте:
4KMnO4+2H2SO4 4MnO3+2K2SO4+O2+2H2O
Слайд 28
Физические свойства
Оксид марганца(VI) образует тёмно-красное аморфное вещество.
Слайд 29
Химические свойства
Разлагается при нагревании:
2MnO3
2MnO2+O2(t=50 )
Реагирует с водой:
3MnO3+H2O 2HMnO4+MnO2
С
щелочами образует соли — манганаты:
MnO3+2NaOH Na2MnO4+H2O
Слайд 30
Марганцовистая кислота
Марганцовистая кислота — слабая двуосновная неорганическая кислота, имеет
химическую формулу H2MnO4. В чистом виде не получена.
Слайд 31
Оксид марганца(VII)
Оксид марганца(VII) Mn2O7 — зеленовато-бурая или красная маслянистая жидкость с
металлическим блеском, неустойчив при комнатной температуре; сильный окислитель, при
соприкосновении с горючими веществами воспламеняет их, возможно со взрывом. Высокотоксичен, сильнейший окислитель. Кислотный
Слайд 32
Физические свойства
Температура плавления — 5,9 °C. Разлагается со взрывом выше
55 °C или при контакте с органическими веществами.
В проходящем свете
имеет красную окраску, в отражённом — зелёную. Образует кристаллы тёмно-зелёного цвета.
Молекулы состоят из пары тетраэдров с атомами кислорода в вершинах и атомами марганца в центрах. Сходная структура наблюдается у оксида хлора(VII), оксида технеция(VII) и оксида рения(VII).
Слайд 33
Получение
Получить оксид марганца(VII) Mn2O7 можно действием холодной концентрированной серной кислоты на перманганат
калия:
2KMnO4+H2SO4 Mn2O7+K2SO4+H2O
Раствор в серной кислоте.
Слайд 34
Химические свойства
Полученный оксид марганца(VII) неустойчив и разлагается на оксид
марганца(IV) и кислород:
2Mn2O7 4MnO2+3O2
Одновременно
выделяется озон:
Mn2O7 2MnO2+O3
Слайд 35
Химические свойства
Взаимодействие с водой
Оксид марганца(VII) взаимодействует с водой,
образуя марганцовую кислоту:
Mn2O7+H2O 2HMnO4
Взаимодействие
с кислотами
Растворяется в серной кислоте, образуя гидросульфат триоксимарганца, более устойчивый при комнатной температуре:
Mn2O7+2H2SO4=2[MnO3] [HSO4] +H2O
Слайд 36
Марганцовая кислота
Марганцо́вая кислота́ — сильная, нестабильная, неорганическая кислота фиолетово-красного цвета с химической формулой HMnO4.
В чистом виде не выделена, существует в виде раствора.
Марганцовая
кислота в чашке Петри
Слайд 37
Физические свойства
Mарганцовая кислота не выделена в свободном виде.
Максимальная концентрация в водном растворе составляет 20 %. Растворы марганцовой
кислоты имеют фиолетовую окраску. При температуре ниже 20 °C образует кристаллогидрат
Слайд 38
Получение
Раствор марганцовой кислоты чаще всего получают путём реакции
разбавленной серной кислоты с раствором перманганата бария, нерастворимый осадок
сульфата бария удаляется путём фильтрации:
Ba(MnO4)2+ H2SO4 2HMnO 4+BaSO4
Слайд 39
Получение
Марганцовая кислота может быть получена взаимодействием оксида марганца(VII) с водой
на холоде:
Mn2O7+ H2O 2HMnO4
Слайд 40
Химические свойства
Марганцовая кислота в растворе медленно разлагается, при
этом выделяется кислород и выпадает осадок диоксида марганца:
4HMnO4 4MnO2 +3O2
+ 2H2O
Слайд 41
Химические свойства
Проявляет общие для сильных кислот свойства, например
вступает в реакции нейтрализации с сильными и слабыми основаниями:
HMnO4 + NaOH
NaMnO4+H2O HMnO4 + NH3* H2O NH4MnO4 +H2O
Слайд 42
Выполнение работы
Цель работы: изучить основные свойства соединений марганца .
Приборы
и реактивы. Фарфоровый тигель, стеклянная полочка, фильтровальная бумага. Едкий натр,
нитрит калия(натрия). Перманганат калия, сульфит натрия, висмутат натрия, оксид марганца (II), судьфат марганца (II), сульфат железа (II), лакмусовая бумага, сероводородная вода. Растворы: едкого натра 2н., соляной кислоты2н., серной кислоты 2н.. азотной кислоты 2н., сульфида аммония 0,5н.,иодида калия 0,1н., пероксида водорода 10%-ный, гексацианноферата (II) калия 0,1н., перманганата калия 0,5 н.
Слайд 43
Опыт № 1.
Получение гидроксида марганца (II) и его
окисление.
В пробирку налили раствор соли марганца и прилили 5-6
капель раствора едкого натрия. Выпал белый осадок гидроксида марганца. В пробирку добавили бромной воды. Выпал черный осадок оксида марганца (IV).
MnSO4+2NaOH=Mn(OH)2+Na2SO4
MnO+Br2+H2O=MnO2+2HBr
Слайд 44
Опыт №2.
Оксид марганца (IV), его получение и свойства.
В
три пробирки налили по 3-5 капель раствора соли марганца
(II) и по 3-4 капли 2 н. раствора щелочи. Выпал белый осадок гидроксида марганца.
MnSO4+2NaOH=Mn(OH)2+Na2SO4
Слайд 45
Опыт 2
В одной пробирке осадок перемешали стеклянной
палочкой и оставили стоять на некоторое время. Во вторую
прилили 2 н. раствора соляной кислоты, в третью – 2 н. раствора щелочи. В обеих пробирках осадок растворился. Следовательно оксид марганца (IV) обладает амфотерными свойствами. В первой пробирке осадок стал бурого цвета.
Mn(OH)2+2HCl=MnCl2+2H2O
Mn(OH)2+4KOH=K4[Mn(OH)6]
Mn(OH)2+O2+H2O=2Mn(OH)4
Слайд 48
Оксид хрома(III)..
Эсколаит. Темно-зеленый, тугоплавкий, термически устойчивый
Слайд 49
Физические свойства
Состояние
твёрдый тугоплавкий порошок зелёного цвета
Молярная масса
152 г/моль
Плотность5,21 г/см³
Термические свойства
Т. плав.2435 °C
Т. кип.4000 °C
Слайд 50
Химические свойства
CrO + H2SO4 = CrSO4
+ H2O
CrO + 2H+ + Cl– = Cr2+
+ 2Cl– + H2O
CrO + 2H+ = Cr2+ + H2O
CrO + 2HCl = CrCl2 + H2O
CrO + 2H+ + SO42– = Cr2+ + SO42– + H2O
CrO + 2H+ = Cr2+ + H2O
Составьте уравнение реакции оксида хрома (II) с соляной и
серной кислотами. Рассмотрите реакции с точки зрения ТЕД.
Слайд 51
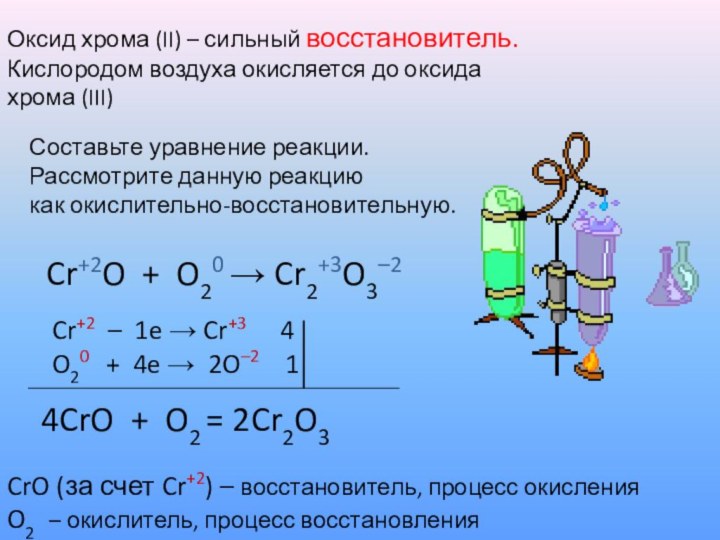
Оксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется
до оксида
хрома (III)
Составьте уравнение реакции.
Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2O + O20 → Cr2+3O3–2
Cr+2 – 1e → Cr+3 4
O20 + 4e → 2O–2 1
4CrO + O2 = 2Cr2O3
CrO (за счет Cr+2) – восстановитель, процесс окисления
O2 – окислитель, процесс восстановления
Слайд 52
Химические свойства:
Реагирует со щелочами при высокой температуре:
Cr2O3
+ NaOH=2NaCrO2 + H2O (400-500°С) Реагирует с дисульфатом калия:
Cr2O3 + 3K2S2O7=Cr2(SO4)3 + 3K2SO4
Окисляется кислородом:
2Cr2O3 + O2=4CrO2 (черн.) [400°С, p]
Реагирует с графитом и хлором:
Cr2O3 + 3C + 3Cl2=2CrCl3 + 3CO
Слайд 53
Химические свойства
Реагирует с сильными окислителями: 5Cr2O3 + 3H2SO4
+ 2H2O + 6NaBrO3=5H2Cr2O7 + 3Br2 + 3Na2SO4
Cr2O3
+ KClO3 + 2K2CO3=2K2CrO4 + KCl + 2CO2 (t=500-700°С)
Cr2O3 + 3NaNO3 + 2Na2CO3=2Na2CrO4 + 3NaNO2 + 2CO2 (t=400-600°С)
Слайд 54
Методы получения:
2Cr + KClO3=Cr2O3 + KCl (500-700°С)
2Cr(OH)3=Cr2O3 + 3H2O
8K2Cr2O7 + C12H22O11=8Cr2O3 + 8K2CO3 +
4CO2 + 11H2O (120-450°С)
Слайд 55
Cr(OH)2
Гидроксид хрома (II)
Гидроксид хрома (II) получают в виде желтого осадка действием
растворов щелочей на соли хрома (II) без доступа воздуха.
Составьте уравнение реакции получения гидроксида хрома (II) действием гидроксида натрия на хлорид хрома (II). Рассмотрите реакцию с точки зрения ТЕД.
CrCl2 + 2NaOH = Cr(OH)2 ↓ + 2NaCl
Cr2+ + 2Cl– + 2Na+ + 2OH– = Cr(OH)2 ↓ + 2Na+ + 2Cl–
Cr2+ + 2OH– = Cr(OH)2 ↓
Слайд 56
Химические свойства:
Гидроксид хрома (II) обладает основными свойствами.
Реагирует
с кислотами
Cr(OH)2 + 2HCl(разб.)=CrCl2 + H2O Окисляется кислородом
в виде суспензии:
4Cr(OH)2 + 2H2O + O2 = 4Cr(OH)3 Реагирует с уксусной кислотой:
2Cr(OH)2 + 4CH3COOH(конц.)=
[Cr2(H2O)2(CH3COO)4] (т.-красн.) + 2H2O
Слайд 57
Соединения хрома (III)
Cr2O3
Оксид хрома () – тугоплавкий порошок
темно-зеленого цвета.
Получение.
В лабораторных условиях термическим разложением
дихромата аммония:
(NH4)2Cr2O7
= Cr2O3 + N2 + 2H2O
В промышленности восстановлением дихромата калия
коксом или серой:
K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S = 2Cr2O3 + K2SO4
t°
t°
t°
Слайд 58
Оксид хрома (III) обладает амфотерными свойствами
При взаимодействии
с кислотами образуются соли хрома (III):
Составьте уравнение
реакции оксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr2O3 + 6HCl = 2CrCl3 + 3H2O
Cr2O3 + 6H+ + 6Cl– = 2Cr3+ + 6Cl– + 3H2O
Cr2O3 + 6H+ = 2Cr3+ + 3H2O
Слайд 59
При сплавлении оксида хрома (III) с оксидами,
гидроксидами
и карбонатами щелочных и
щелочноземельных металлов образуются
хроматы (III) (хромиты):
Сr2O3
+ Ba(OH)2 = Ba(CrO2)2 + H2O
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
t°
t°
Оксид хрома (III) нерастворим в воде.
Слайд 60
В окислительно-восстановительных реакциях оксид хрома (III)
ведет себя как
восстановитель:
Cr2O3 + KOH + KMnO4 → K2CrO4 + MnO2
+ H2O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Cr2O3 + KOH + Сa(ClO)2 → K2CrO4 + CaCl2 + H2O
Cr2O3 + O2 + Na2CO3 → Na2CrO4 + CO2
Cr2O3 + KClO3 + Na2CO3 → Na2CrO4 + KCl + CO2
Cr2O3 + NaNO3 + Na2CO3 → Na2CrO4 + NaNO2 + CO2
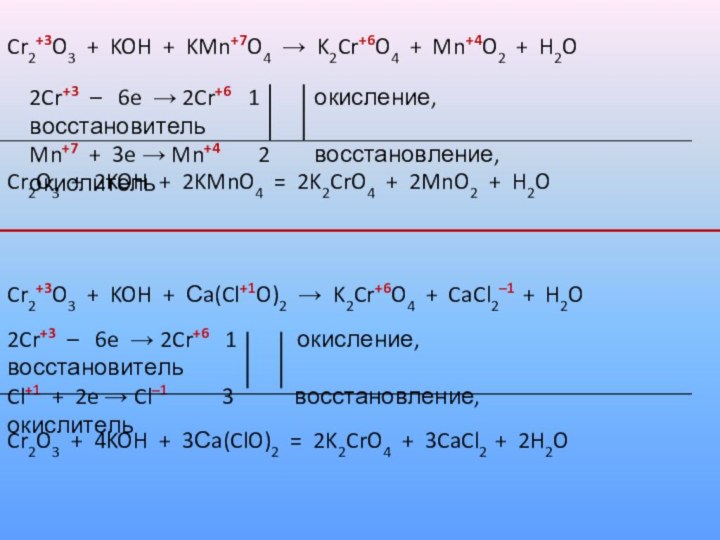
Слайд 62
Cr2+3O3 + KOH + KMn+7O4 → K2Cr+6O4 +
Mn+4O2 + H2O
2Cr+3 – 6e → 2Cr+6
1 окисление, восстановитель
Mn+7 + 3e → Mn+4 2 восстановление, окислитель
Cr2O3 + 2KOH + 2KMnO4 = 2K2CrO4 + 2MnO2 + H2O
Cr2+3O3 + KOH + Сa(Cl+1O)2 → K2Cr+6O4 + CaCl2–1 + H2O
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+1 + 2e → Cl–1 3 восстановление, окислитель
Cr2O3 + 4KOH + 3Сa(ClO)2 = 2K2CrO4 + 3CaCl2 + 2H2O
Слайд 63
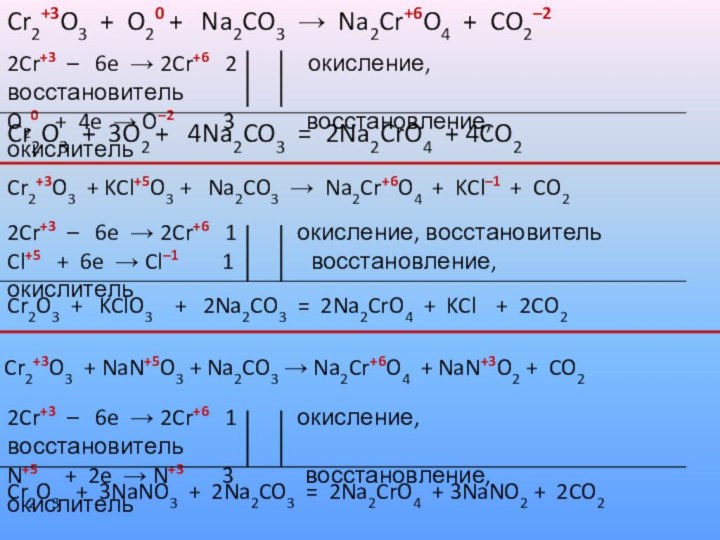
Cr2+3O3 + O20 + Na2CO3 → Na2Cr+6O4
+ CO2–2
2Cr+3 – 6e → 2Cr+6 2
окисление, восстановитель
O20 + 4e → O–2 3 восстановление, окислитель
Cr2O3 + 3O2 + 4Na2CO3 = 2Na2CrO4 + 4CO2
Cr2+3O3 + KCl+5O3 + Na2CO3 → Na2Cr+6O4 + KCl–1 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+5 + 6e → Cl–1 1 восстановление, окислитель
Cr2O3 + KClO3 + 2Na2CO3 = 2Na2CrO4 + KCl + 2CO2
Cr2+3O3 + NaN+5O3 + Na2CO3 → Na2Cr+6O4 + NaN+3O2 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
N+5 + 2e → N+3 3 восстановление, окислитель
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
Слайд 64
Применение
основной пигмент для зелёной краски
абразив — компонент полировальных паст
(например ГОИ)
катализатор в ряде органических реакций
компонент шихт для получения шпинелей и искусственных
драгоценных камней
компонент термитных смесей и других реакций СВС
компонент ТРТ
компонент магнезиальных огнеупоров
Слайд 65
Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действием
растворов щелочей
или аммиака на растворы
солей хрома (III).
Составьте
уравнение реакции получения
Cr(OH)3 действием раствора аммиака на
хлорид хрома (III):
CrCl3 + 3(NH3·H2O) = Cr(OH)3 + 3NH4Cl
Лабораторный опыт № 1
К раствору хлорида хрома (III) прилейте раствор
аммиака. Что наблюдаете?
Слайд 66
Химические свойства:
Гидроксид хрома (III) обладает амфотерными свойствами.
Реагирует
с разбавленными кислотами: Cr(OH)3 + 3HCl=CrCl3 + 3H2O
Реагирует
с плавиковой кислотой:
Cr(OH)3 + 3HF3=CrF3 + 3H2O
Реагирует с концентрированными растворами щелочей:
Cr(OH)3 + 3NaOH=Na3[Cr(OH)6]
Окисление пероксидом водорода в щелочной среде:
2Cr(OH)3 + 4NaOH + 3H2O2=2Na2CrO4 + 8H2O
Слайд 67
Получают CrO3 действием избытка
концентрированной серной кислоты
на насыщенный
водный раствор
дихромата натрия:
Na2Cr2O7 + 2H2SO4 = 2CrO3 + 2NaHSO4 + H2O
Оксид хрома (VI) очень ядовит.
4CrO3 → 2Cr2O3 + 3O2↑.
При нагревании выше 250 °C разлагается:
Оксид хрома (VI) CrO3 — хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы.
Слайд 68
CrO3 — кислотный оксид.
С избытком воды образуется
хромовая
кислота H2CrO4
CrO3 + Н2O = Н2CrO4
При
большой концентрации CrO3 образуется дихромовая
кислота Н2Cr2О7
2CrO3 + Н2O = Н2Cr2O7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7 + Н2О = 2Н2CrO4
При растворении в воде образует кислоты.
Эти кислоты – неустойчивые. Существуют только в растворе.
Между ними в растворе устанавливается равновесие
2Н2CrO4 ↔ Н2Cr2O7 + Н2O
При взаимодействии CrO3 со щелочами образуются хроматы
CrO3 + 2KOH → K2CrO4 + H2O.
Слайд 69
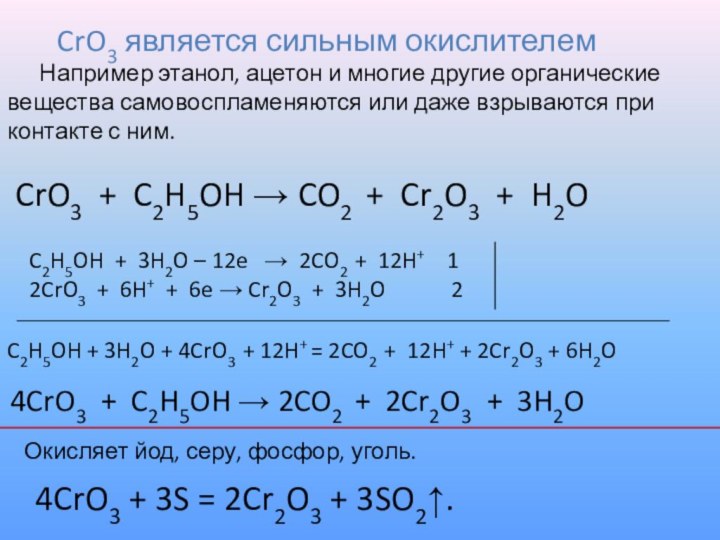
CrO3 является сильным окислителем
Например этанол, ацетон и многие другие
органические вещества самовоспламеняются или даже взрываются при контакте с ним.
Окисляет йод, серу, фосфор, уголь.
4CrO3 + 3S = 2Cr2O3 + 3SO2↑.
CrO3 + C2H5OH → CO2 + Cr2O3 + H2O
C2H5OH + 3H2O – 12e → 2CO2 + 12H+ 1
2CrO3 + 6H+ + 6e → Cr2O3 + 3H2O 2
4CrO3 + C2H5OH → 2CO2 + 2Cr2O3 + 3H2O
C2H5OH + 3H2O + 4CrO3 + 12H+ = 2CO2 + 12H+ + 2Cr2O3 + 6H2O
Слайд 70
Применение
Используется для получения хрома электролизом, электролитического хромирования; хроматированияоцинкованных деталей, в качестве сильного окислителя,
изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в
производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Слайд 71
Оксид хрома(VI) очень ядовит и канцерогенен, как и многие другие соединения шестивалентного
хрома. Летальная доза для человека при попадании внутрь 0,08
г/кг.
Токсичность
Слайд 72
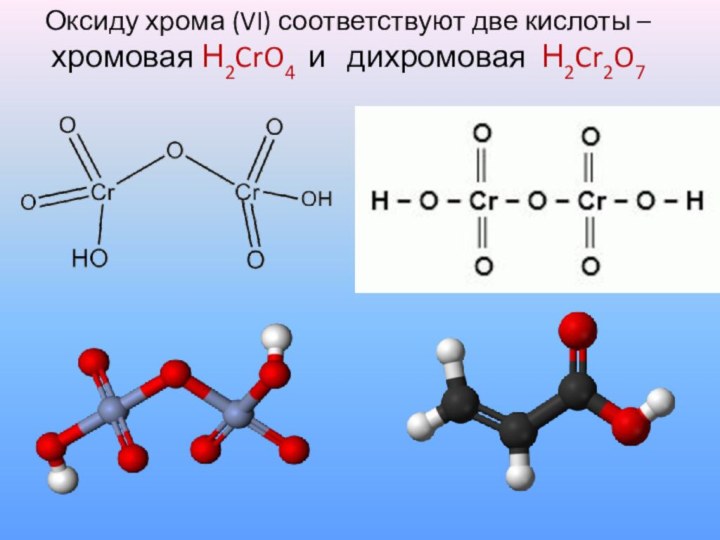
Оксиду хрома (VI) соответствуют две
кислоты –
хромовая Н2CrO4 и
дихромовая Н2Cr2O7
Слайд 73
Хромовая кислота — кристаллическое вещество красного
цвета; выделена в свободном состоянии при охлаждении насыщенных водных
растворов CrO3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
Слайд 74
В ряду гидроксидов хрома различных степеней
окисления
Cr(ОН)2 — Cr(ОН)3 — Н2CrО4
закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства.
Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III).
Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III).
Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Слайд 75
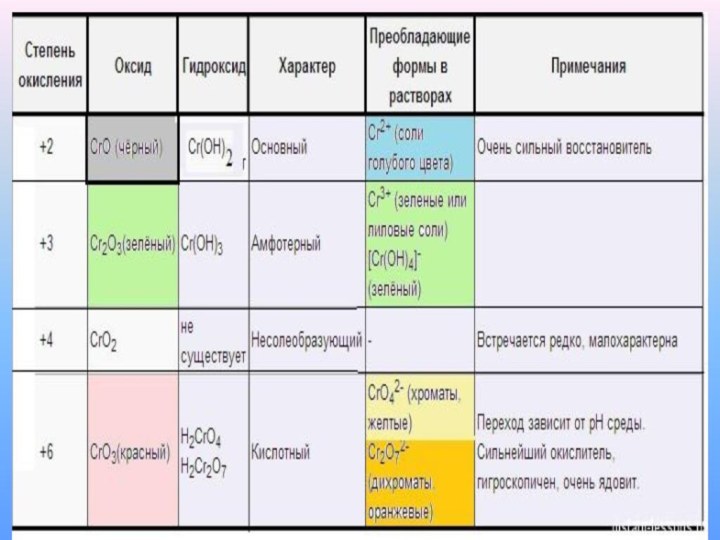
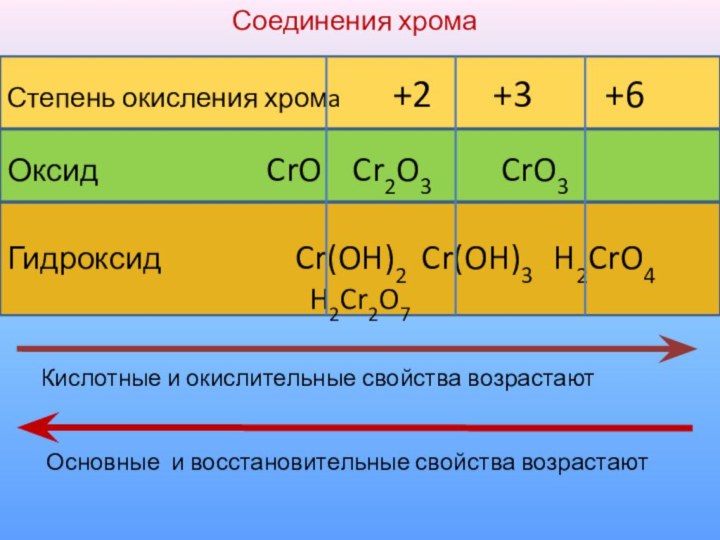
Степень окисления хромa +2
+3 +6
Оксид
CrO Cr2O3 CrO3
Гидроксид Cr(OH)2 Cr(OH)3 H2CrO4
H2Cr2O7
Кислотные и окислительные свойства возрастают
Основные и восстановительные свойства возрастают
Соединения хрома
Слайд 76
Вывод
Переходные металлы d-элементы образуют несколько оксидов и гидроксидов. В
зависимости от изменения С.О. и радиуса иона в данных
соединениях свойства изменяются. При увеличении С.О. радиус иона уменьшается, ослабевают основные свойства, нарастают кислотно-основные, а затем кислотные как у оксидов, так и у гидроксидов.
Слайд 77
Закрепление
— гидроксиды
1) Что происходит со С.О.?
Ответ:
С.О. возрастает.
Слайд 78
Задание:
Составить формулу оксида и гидроксида хрома (III).
Уравнениями реакций подтвердить их амфотерность.
Ответ: Сr2O3 — оксид хрома (II).
кислотный
оксид взаимодействия с щелочью.
основной оксид взаимодействия с кислотой.
Слайд 79
Закрепление
2) Как вы думаете, а радиус иона как
изменяется?
Ответ: радиус иона хрома с увеличением С.О. уменьшается.
3) Как
эти изменения сказываются на свойствах соединения?
Ответ: происходит изменение свойств оксидов и гидроксидов от основного, через амфотерный к кислотным.
Слайд 80
Задание
— гидроксид хрома (III).
Cr(OH)3
— осадок исчезает.
Гидроксид
хрома — основание, взаимодействует с кислотой.
— осадок исчезает.
Гидроксид хрома
проявляет кислотные свойства, т. к. взаимодействует с растворами щелочи.
Слайд 81
Осуществи превращения
Cr-Cr2O3---CrCl2--CrCl3 Cr(OH)3↓
K3[Cr(OH)6]
NaCrO2
Слайд 82
ответ
4Cr+3O2=2Cr2O3
Cr2O3+2NaOH→−t,∘C 2NaCrO2+H2O
4CrCl2+O2+4HCl=4CrCl3+2H2O
2CrCl3+3Na2S+6H2O=2Cr(OH)3↓+6NaCl+3H2S↑
Cr(OH)3+3KOH(водн.)=K3[Cr(OH)6]
1)Cr2O3 + 3C + 3Cl2 =t=> 2CrCl3
+ 3CO порядка 700-900 темп.
2)2CrCl3 + H2 =t=> 2CrCl2
+ 2HCl 400-500 темп.
Слайд 83
Домашнее задание
Параграф 34
Генетический ряд марганца составь и осуществи
превращения







































































![Презентация по химии 11 класс Изменение свойств оксидов и гидроксидов металлов Осуществи превращенияCr-Cr2O3---CrCl2--CrCl3 Cr(OH)3↓K3[Cr(OH)6]NaCrO2](/img/tmb/6/567502/c9bf9347117362982e701c294d7ee8ce-720x.jpg)
![Презентация по химии 11 класс Изменение свойств оксидов и гидроксидов металлов ответ4Cr+3O2=2Cr2O3Cr2O3+2NaOH→−t,∘C 2NaCrO2+H2O4CrCl2+O2+4HCl=4CrCl3+2H2O2CrCl3+3Na2S+6H2O=2Cr(OH)3↓+6NaCl+3H2S↑Cr(OH)3+3KOH(водн.)=K3[Cr(OH)6]1)Cr2O3 + 3C + 3Cl2 =t=> 2CrCl3 + 3CO порядка 700-900](/img/tmb/6/567502/4d98e468effa21b788b939a8dc6a042a-720x.jpg)































