- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему спирты
Содержание
- 2. Получение предельных одноатомных спиртов
- 3. Лабораторные Гидролиз галогеналкановГидратация этиленовых углеводородов Промышленные.Синтез метанола из синтез-газаГидратация этиленаБрожение
- 4. Гидролиз галогеналкановCH3–CH2–Br + KOH→ CH3–CH2–ОН + KBr.
- 5. Гидратация этиленаН2С = СН2 + НОН
- 6. Получение метанола из синтез-газаСО + Н2
- 7. БрожениеГЛЮКОЗА(С6Н12О6) 2 С2Н5 – ОН + 2 СО2ферменты
- 8. Физические свойства спиртовС увеличением молекулярной массы плотность
- 9. ХИМИЧЕСКИЕ СВОЙСТВА ПРЕДЕЛЬНЫХ ОДНОАТОМНЫХ СПИРТОВ
- 10. Реакции горенияС2Н5ОН + 3О2 = 2СО2 + 3Н2О С4Н9ОН +
- 11. Внутримолекулярная дегидратация спиртов
- 12. Межмолекулярная дегидратация спиртов
- 13. Взаимодействие спиртов с карбоновыми кислотами называется реакцией этерификации, которая протекает по следующей схеме сложный эфир
- 14. Предельные одноатомные cпирты CH3 –CH2–OH + CuO
- 15. Метанол (метиловый спирт) Бесцветная жидкость с
- 16. Скачать презентацию
- 17. Похожие презентации
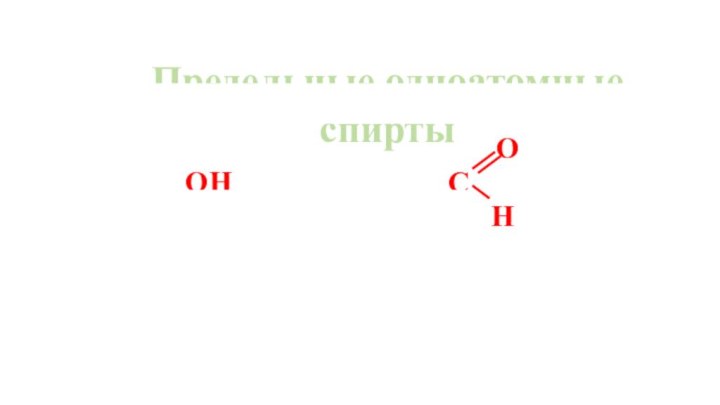
Получение предельных одноатомных спиртов














Слайд 6
Получение метанола из
синтез-газа
СО + Н2
СН3– ОН
синтез-газ метанол
220- 230оС, 25-45МПа,ZnO , Cu
Слайд 8
Физические свойства спиртов
С увеличением молекулярной массы плотность увеличивается,
многоатомные спирты вязкие
Одноатомные спирты имеют резкий запах, летучи.
Первые представители
С1 – С3 хорошо растворяются в воде.Т.о, спирты с большой молекулярной массой в воде будут растворяться хуже.
Слайд 10
Реакции горения
С2Н5ОН + 3О2 = 2СО2 + 3Н2О
С4Н9ОН + 6
О2 = 4СО2 + 5 Н2О
2С5Н11ОН + 15 О2 = 10 СО2 +12
Н2О
Слайд 12
Межмолекулярная дегидратация спиртов
H2SO4
C2H5OH + C2H5OH C2H5-О-C2H5 + H2O
этанол этанол диэтиловый эфир
Слайд 13 Взаимодействие спиртов с карбоновыми кислотами называется реакцией этерификации,
которая протекает по следующей схеме
сложный эфир
Слайд 15
Метанол (метиловый спирт)
Бесцветная жидкость
с температурой
кипения
64,7 0С, с характерным запахом.
Легче воды. Горит
чуть голубоватым пламенем.
Историческое название –
древесный спирт.
Метанол – прекрасный
растворитель, его используют для производства формальдегида,
некоторых лекарственных веществ.