одну или несколько карбоксильных групп.
Карбоксильная группа – группа
атомовСостав этих кислот будет отражаться общей формулой CnH2nO2, или CnH2n+1COOH, или RCOOH.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть













щавелевая кислота
O
OH
- C
O
OH
H
OH
метановая (муравьиная) кислота
O
O
OH
HO
этандионовая (щавелевая) кислота
O
O
катализатор
P (красный)
хлоруксусная кислота
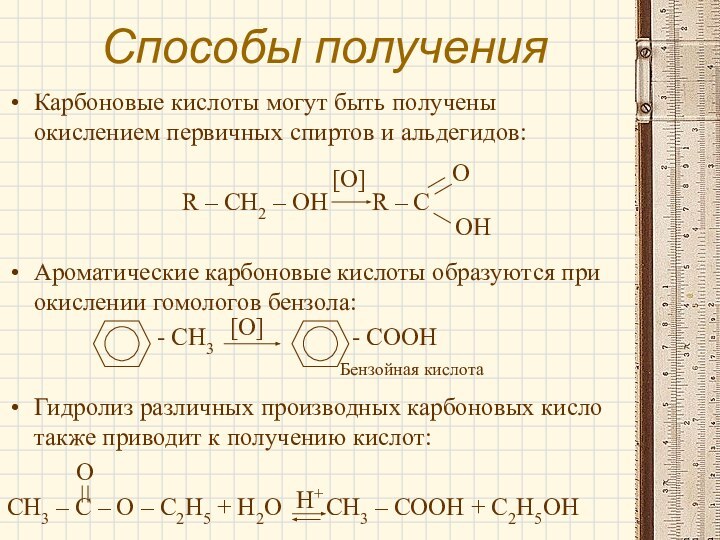
[O]
O
OH
Бензойная кислота
[O]
H+
O