Слайд 2
Металлы – химические элементы , образующие в свободном
состоянии простые вещества с металлической связью.
М.В. Ломоносов -
металлы «светлое тело, которое ковать можно»
Что такое металлы
Ba
Cr
K
Li
Слайд 3
Роль металлов в жизни человека и общества.
В древности
человеку были известны только 7металлов: Золото(Au),Серебро(Ag),Медь(Cu),Олово(Sn), Свинец(Pb),Железо(Fe) и Ртуть(Hg).
Сначала
человек познакомился с металлами,которые встречаются в самородном виде - это золото,серебро и медь.
Остальные металлы появились после того,как человек научился добывать их из руд с помощью огня.
Каменный век → Медный век → Бронзовый век → Железный век.
Слайд 4
Из серебра,золота и меди чеканили монеты.
1. Серебряная
монета с изображением богини Афины и совы.
2. Золотая
монета с изображением Александра Македонского
и бога Зевса.
3. Медная монета в виде дельфина.
Из металлов и их сплавов изготавливаются памятники,статуи.
Царь-пушка
(бронза)
Царь-колокол (бронза) Статуя Колосса Родосского (Бронза)
Слайд 5
Материал, из которого сооружена пирамида Хеопса,изготовлен из камня
и меди.
Слайд 7
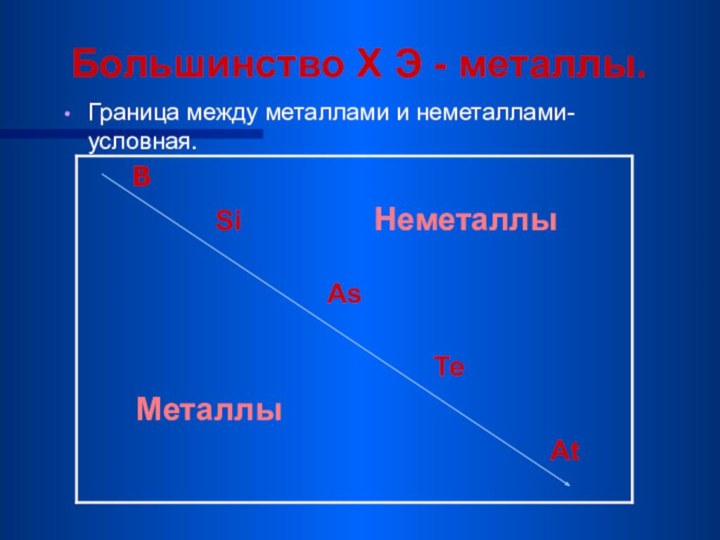
Большинство Х Э - металлы.
Граница между металлами
и неметаллами-условная.
Слайд 8
Металлы Переходный элемент Неметаллы
Основный
Амфотерный Кислотный
оксид оксид оксид
Основание Амфотерный Кислота
гидроксид
Na Al S
Na2O Al2O3 SO3
NaOH Al(OH)3 H2SO4
Слайд 9
Закономерность изменения свойств металлов в группе.
Заряд ядра увеличивается,так
как увеличивается порядковый номер.
R увеличивается,так как увеличивается количество энергетических
уровней.
Число электронов на последнем уровне постоянно.
Способность к отдаче электронов увеличивается.
Восстановительные способности и металлические свойства увеличиваются.
Слайд 10
Закономерность изменения свойств металлов в периоде.
Заряд ядра увеличивается,так
как увеличивается порядковый номер.
R уменьшается,так как заряд ядра больше,
способность притягивать электроны возрастает, за счет этого происходит стягивание электронных оболочек.
Число электронов на внешнем уровне увеличивается,так как растёт номер группы.
Восстановительные способности и неметаллические свойства уменьшаются.
Слайд 11
Физические свойства металлов.
Все металлы обладают общими физическими свойствами,так
как во всех металлах существует металлическая химическая связь и
металлическая кристаллическая решётка.
Слайд 12
Все металлы- твердые вещества, кроме ртути.
самый мягкий – калий,
самый твердый – хром
Слайд 13
Пластичные
Au, Ag, Cu, Sn, Pb,Zn, Fe
уменьшается
Слайд 14
Температура плавления
Легкоплавкие
Тугоплавкие
Hg, Ga, Cs, In,
Bi W, Mo, V, Cr
Легкие
Тяжелые
(Li–самый легкий, (осмий – самый
K,Na, Mg) тяжёлый Ir, Pb)
Слайд 17
Щелочные металлы
Переходные металлы
Щелочно-земельные металлы
По химической
активности
Слайд 18
Химические свойства металлов
Металлы в химических реакциях являются восстановителями,
при этом они окисляются
Mo – ne =Mn+
Al, Be, Mg, Ca, Li, Na, K, Rb, Cs
Восстановительная способность возрастает
Слайд 19
Металлы вытесняются из их соединений другими металлами
Н.Н. Бекетов
– создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов)
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.
Слайд 20
Взаимодействуют с простыми веществами
С элементами VII группы (при
обычных условиях)
2Na + Cl2 = 2 Na Cl
- С элементами VI группы (труднее)
Mg + O2 = 2Mg O
C элементами V группы (в жестких условиях)
3Ca + 2P =Ca3P2
Слайд 21
Взаимодействие со сложными веществами
С растворами кислот (металлы, стоящие
в ряду напряжений до «Н»)
Zn + H2SO4 = Zn S O4 + H2↑
C растворами солей металлов, стоящих в ряду напряжений правее
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
C водой (активные)
2Na + 2H2O =2Na OH + H2↑
Реакция идет в том случае, если образуется растворимое основание.
Слайд 22
Применение металлов
Станко-
строение
медицина
Сельское хозяйство
получение сплавов
В быту
Металлургическая
промыш-ленность
Слайд 23
Получение металлов
Пирометаллургический способ -восстановление углеродом, оксидом
углерода (II), водородом при высокой температуре.
Алюминотермический способ – восстановление
металлов с помощью алюминия.
Гидрометаллургический способ – получение из руды более активным металлом или из растворов
Электролиз – с помощью электрического тока из расплавов или растворов