световой энергии атомами анализируемых веществ.
Молекулярно-адсорбционный анализ – анализ по
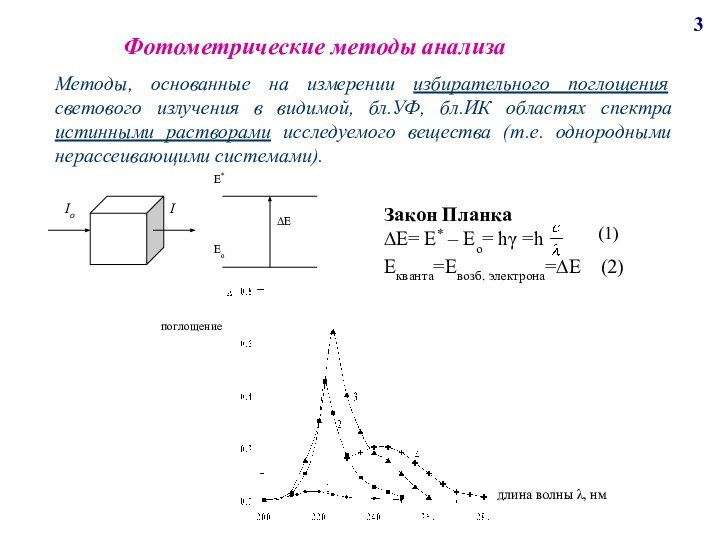
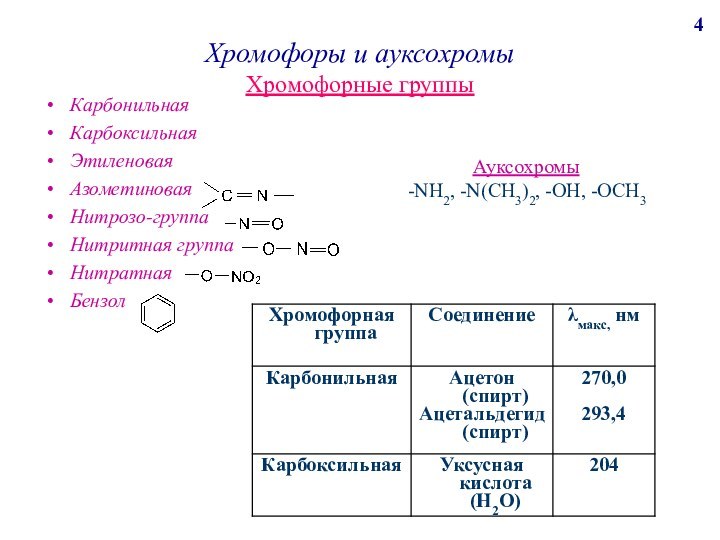
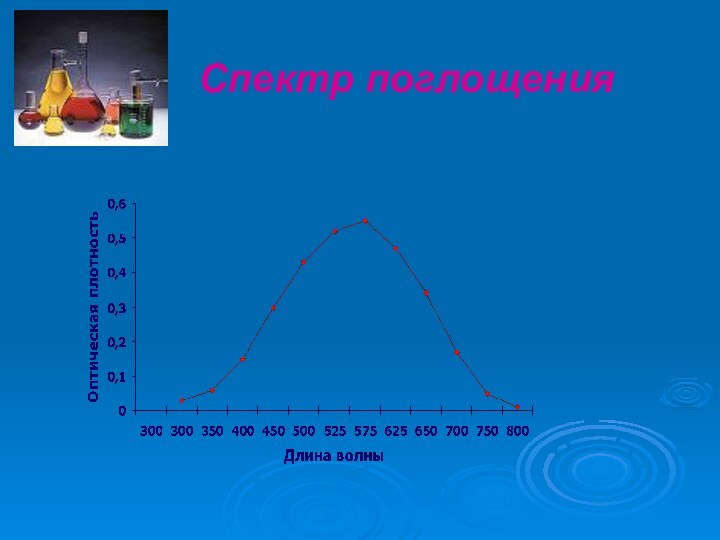
поглощению света молекулами анализируемого вещества и сложными ионами (в бл.УФ, видимой, бл.ИК). К нему относим фотоэлектроколориметрию, спектрофотометрию, ИК-спектроскопию.Анализ по поглощению и рассеиванию световой энергии взвешанными частицами анализируемого вещества, т.е. дисперсными системами (турбидиметрия, нефелометрия).
Люминесцентный анализ – основанный на измерении излучения, выделенного возбужденными частицами исследуемого объекта.
1










![Фотометрический анализ Влияние концентрации [H+] на формы существования частиц1 – CrO4-; 1 – Cr2O72-](/img/tmb/13/1246172/68c65b7aa648a9d66227d9af70f70d8f-720x.jpg)