- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
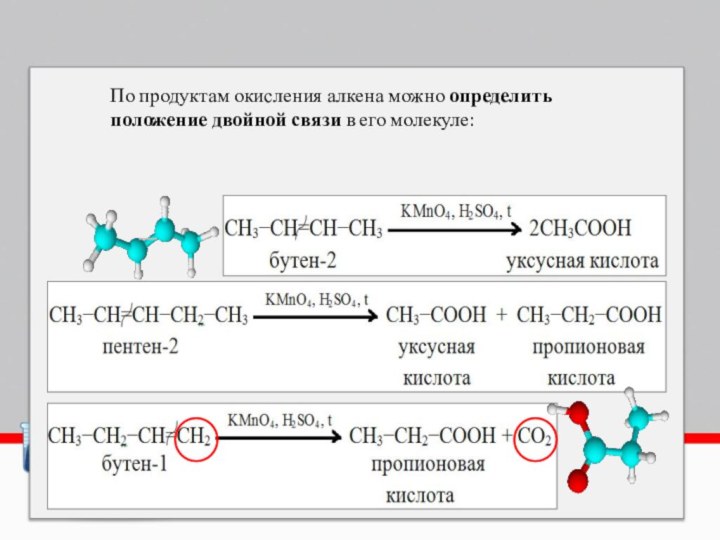
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ЕГЭ по химии №33. ОВР с участием органических соединений
Содержание
- 2. В цепочках превращений органических
- 3. . Изменение степени окисления атомов углерода в молекулах органических соединений
- 4. Степени окисления атома углерода
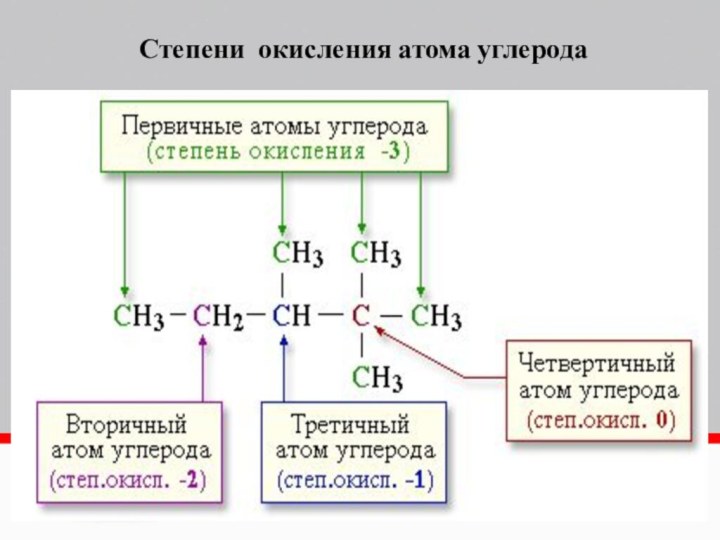
- 5. КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и H2O2Сине-зеленый
- 7. АлканыПри обычных условиях алканы устойчивы к действию
- 8. АлкеныПри мягком окислении алкены превращаются в гликоли
- 9. По продуктам окисления алкена можно определить положение двойной связи в его молекуле:
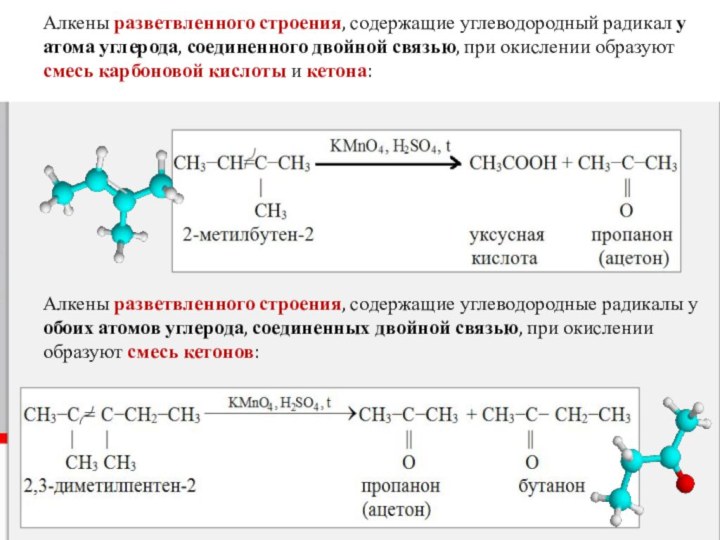
- 10. Алкены разветвленного строения, содержащие углеводородный радикал у
- 11. АлкеныCH3-CH=CH-CH3+O3+H2O=
- 12. Пример: 3CH3 - CH = CH -
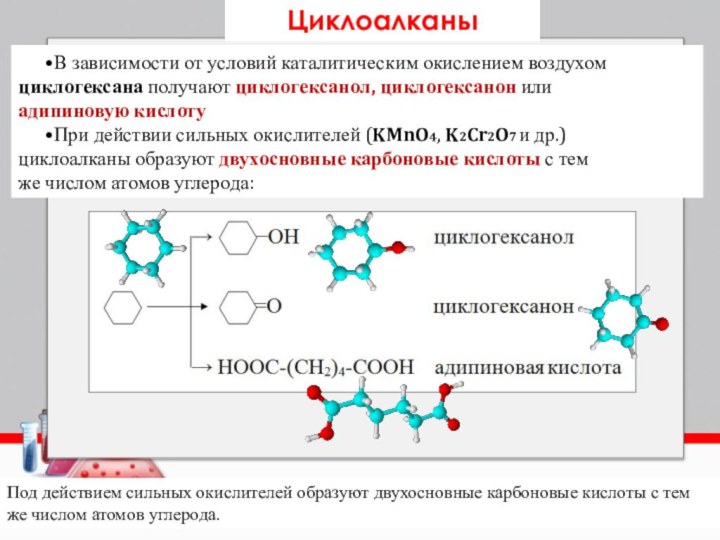
- 13. Под действием сильных окислителей образуют двухосновные карбоновые
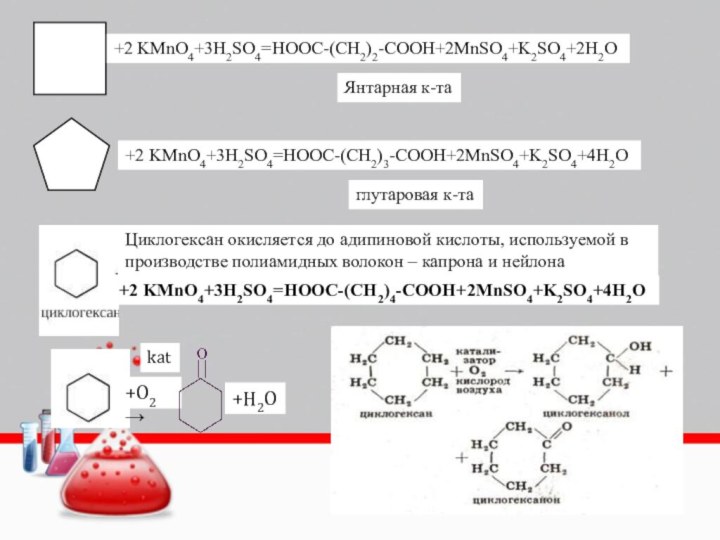
- 14. +2 KMnO4+3H2SO4=HOOC-(CH2)2-COOH+2MnSO4+K2SO4+2H2OЯнтарная к-та+2 KMnO4+3H2SO4=HOOC-(CH2)3-COOH+2MnSO4+K2SO4+4H2Oглутаровая к-та+2 KMnO4+3H2SO4=HOOC-(CH2)4-COOH+2MnSO4+K2SO4+4H2OЦиклогексан окисляется
- 15. 5 +
- 16. Ацетилен окисляется водным раствором KMnO4 до оксалата
- 17. +H2O2=Можно окислить озоном с образованием
- 18. Более сильные окислители – KMnO4 в кислой
- 19. Под действием сильных окислителей (KMnO4 в
- 20. Реакция анилина с хромовой смесью. Получается чёрный
- 21. В нейтральной или слабощелочной среде
- 23. Окисление предельных одноатомных спиртовНепосредственным продуктом окисления первичных
- 24. Для окисления вторичных спиртов наиболее часто используют
- 25. Например, окисление этанола дихроматом калия на холоде
- 26. 5CH3-CH2-OH+4KMnO4+6H2SO4=5CH3COOH+2K2SO4+4MnSO4+11H2OCH3-CH2-OH+4KMnO4+5KOH= CH3COOK+4K2MnO4+4H2O3CH3-CH2-OH+4KMnO4=3 CH3COOK+4MnO2+KOH+4H2OОкислителем одноатомных спиртов может быть
- 27. Вторичные спирты окисляются до кетонов:Третичные спирты устойчивы к окислению!Окисление трет-бутанола в «жёстких» условиях:
- 28. Окисление гликолейДвухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании
- 29. 6КMnO4+9H2SO4→55HH+6MnSO4 +3К2SO4 + 24Н2ООкисление многоатомных спиртов
- 30. КMnO4H2SO4+ CO2 ↑+
- 31. +H2O2→+H2OОкисление фенолапирокатехин3+2K2Cr2O7-+8H2SO4→3+ 2K2SO4 + 2Cr2(SO4)3 + 11H2Oбензохинон
- 32. C6H5-CH(OH)-CH3+H2O2→C6H5-CO-CH3+2H2OC6H5CH(OH)CH3 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + C6H5COOH +СО2 +5H2O3C6H5CH(OH)CH3 + K2Cr2O7 + 4H2SO4 = 3C6H5COCH3 + Cr2(SO4)3 + K2SO4 + 7H2OОкисление ароматических спиртов
- 33. Альдегиды легко окисляются до карбоновых кислотАроматические альдегидылегко
- 34. Качественные реакции на альдегидыОкисление гидроксидом меди(II)Реакция «серебряного зеркала»Соль, а не кислота!
- 35. Кетоны окисляются с трудом, слабые окислители на
- 36. Окисление альдегидов5CH3–CH=O + 2KMnO4 + 3H2SO4 = 5CH3–COOH + 2MnSO4 +
- 37. Окисление карбоновых кислотНепредельные карбоновые кислотыокисляются водным раствором
- 38. Особые свойства щавелевой кислотыЛегко окисляется под действием
- 39. Окисление карбоновых кислотСреди кислот сильными восстановительными свойствами
- 40. Окисление глюкозы до глюконовой кислоты реактивом Толленсагидроксидом меди Cu(OH)2 в щелочной средебромной водойОкисление моносахаридов
- 41. Окисление глюкозы до глюкаровой (сахарной) кислотыразбавленной азотной
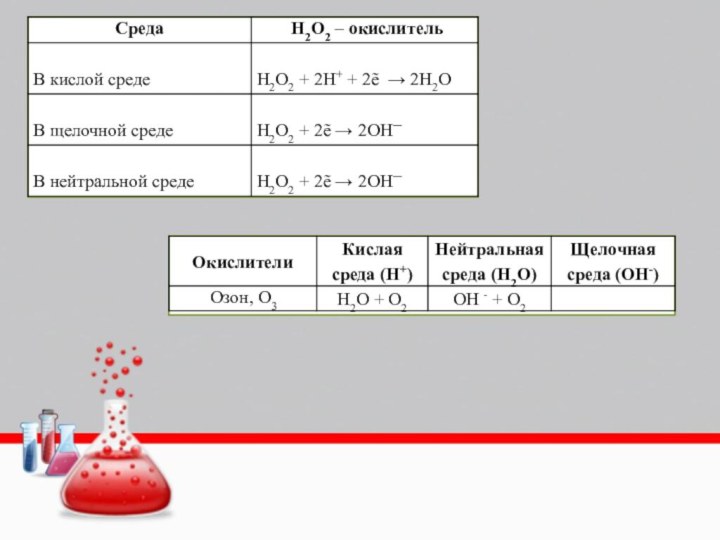
- 42. Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]Cl C6H5-NH2+CH3Br=[C6H5-NH2CH3]Cl C6H5-NH2+CH3-COCl=C6H5-NH-CO-CH3+HCl C6H5-NH2+C2H5-COOH=C6H5-NH-CO-C2H5+H2O C6H5-NH2+HNO2=C6H5-OH+N2+H2O C6H5-NH2+3Br2=C6H2Br3NH2+HBr C6H5-NH2+NaNO2+2HCl=C6H5-NNCl+2H2O+NaCl Гидролизуется при t до N2 фенола и HCl
- 43. Реакции, вызывающие трудностиR-NO2+9Fe+4H2O→4R-NH2+3Fe3O4R-NO2+3Zn+7HCl→R-NH3Cl+3ZnCl2+2H2OR-NO2+3Fe+7HCl→R-NH3Cl+3FeCl2+2H2OR-NO2+2Al+2NaOH+4H2O→R-NH2+2Na[Al(OH)4]CH3CH2OH + PCl5 = C2H5Cl + POCl3+HClCH3CH2OH + PCl3 = 3C2H5Cl + H3РO3
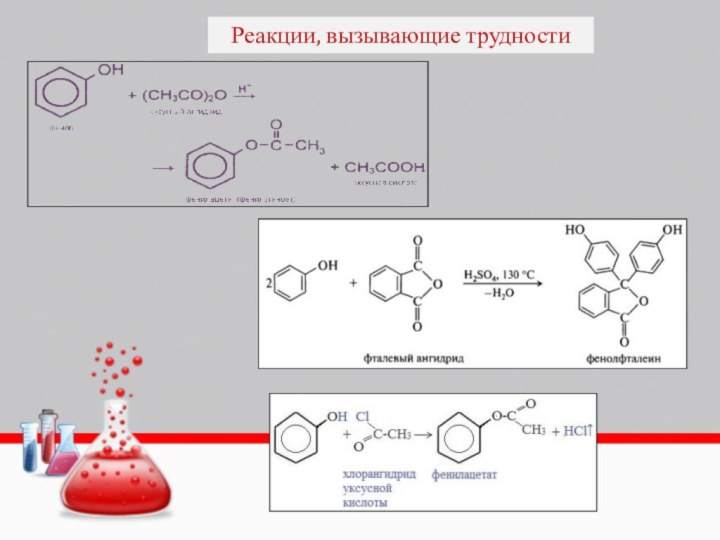
- 44. Реакции, вызывающие трудности
- 45. Скачать презентацию
- 46. Похожие презентации



![ЕГЭ по химии №33. ОВР с участием органических соединений КMnO4K2Cr2O7Основные окислителиMnSO4MnO2K2MnO4Cr2(SO4)3Cr(OH)3K3[Cr(OH)6]O3 и H2O2Сине-зеленый](/img/tmb/6/579059/a8f9cdf43be97847259ad54ca2175de7-720x.jpg)














![ЕГЭ по химии №33. ОВР с участием органических соединений Реакции, вызывающие трудностиC6H5-NH2+HCl=[C6H5-NH3]Cl C6H5-NH2+CH3Br=[C6H5-NH2CH3]Cl C6H5-NH2+CH3-COCl=C6H5-NH-CO-CH3+HCl C6H5-NH2+C2H5-COOH=C6H5-NH-CO-C2H5+H2O C6H5-NH2+HNO2=C6H5-OH+N2+H2O C6H5-NH2+3Br2=C6H2Br3NH2+HBr C6H5-NH2+NaNO2+2HCl=C6H5-NNCl+2H2O+NaCl Гидролизуется при t до N2 фенола и HCl](/img/tmb/6/579059/7464634c6165124d6bdd8cb2d288e22e-720x.jpg)
![ЕГЭ по химии №33. ОВР с участием органических соединений Реакции, вызывающие трудностиR-NO2+9Fe+4H2O→4R-NH2+3Fe3O4R-NO2+3Zn+7HCl→R-NH3Cl+3ZnCl2+2H2OR-NO2+3Fe+7HCl→R-NH3Cl+3FeCl2+2H2OR-NO2+2Al+2NaOH+4H2O→R-NH2+2Na[Al(OH)4]CH3CH2OH + PCl5 = C2H5Cl + POCl3+HClCH3CH2OH + PCl3 = 3C2H5Cl + H3РO3](/img/tmb/6/579059/19f4d5b31a70070c736747a8c85d88ca-720x.jpg)

Слайд 5
КMnO4
K2Cr2O7
Основные окислители
MnSO4
MnO2
K2MnO4
Cr2(SO4)3
Cr(OH)3
K3[Cr(OH)6]
O3 и H2O2
Сине-зеленый
Слайд 7
Алканы
При обычных условиях алканы устойчивы к действию таких
окислителей, как растворы KMnO4, K2Cr2O7.
В результате контролируемого каталитического
окисления алканов кислородом в определенных условиях, т.е. при различных температурах и давлении, можно получить спирты, альдегиды, кетоны и карбоновые кислоты, например: Обратите внимание на то, что реакция каталитического окисления бутана используется в промышленности для получения уксусной кислоты
Слайд 8
Алкены
При мягком окислении алкены превращаются в гликоли (двухатомные
спирты), среда нейтральная или слабощелочная. Реакция Вагнера.
3CH2=CH2 +
2 KMnO4 + 4 H2O ——> 3 CH2OH-CH2OH + 2 KOH + 2MnO2Слабощелочная среда (в общем виде):
R-CH=CH-R+ 2KMnO4+2KOH→R-CH(OH)-CH(OH)-R+2K2MnO4
WO3
Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но σ-связи. В зависимости от строения алкена в результате этой реакции образуются карбоновые кислоты, CO2 и кетоны.
Слайд 10 Алкены разветвленного строения, содержащие углеводородный радикал у атома
углерода, соединенного двойной связью, при окислении образуют смесь карбоновой
кислоты и кетона:Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
Слайд 11
Алкены
CH3-CH=CH-CH3+O3+H2O=
+H2O2
CH3-CH=CH-CH3+O3+H2O= 2
+H2O2CH3-CH(CH3)=CH-CH3+O3+H2O= +CH3-COH+H2O2
Слайд 12
Пример:
3CH3 - CH = CH - CH
= CH2+4KMnO4+8 H2O= 4KOH+4MnO2+3CH3 - CH - CH -
CH - CH2│ │ │ │
OH OH OH OH
пентадиен - 1,4 пентантетраол - 1,2,3,4
Алкадиены
С5H8+4KMnO4+6H2SO4=2CO2+C3H4O4+2K2SO4+4MnSO4+8H2O
Малоновая кислота
Уравнение окисления бутадиена-1,3 избытком раствора перманганата калия в кислой среде: 5CH2=CH-CH=CH2 + 22KMnO4 + 33H2SO4 =20CO2+ 11K2SO4 + 22MnSO4 + 48H2O
CH2=C=CH2 +KMnO4=CH2OH-CO-CH2OH +K2MnO4+H2O
1,3-дигидроксиацетон
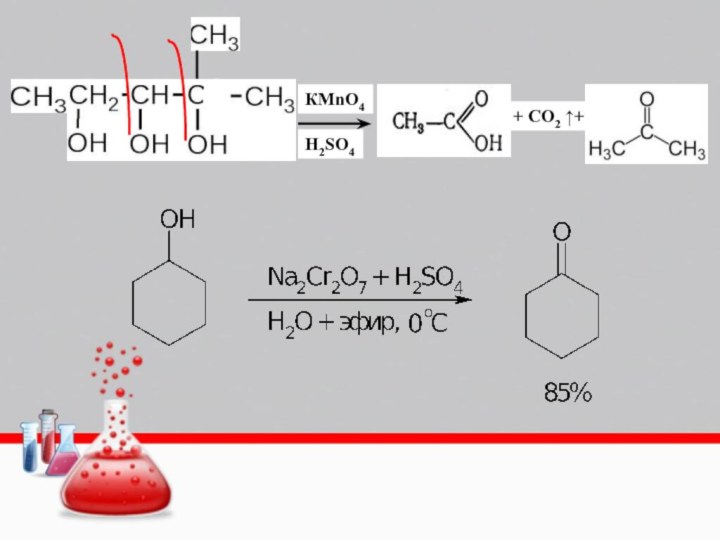
Слайд 13 Под действием сильных окислителей образуют двухосновные карбоновые кислоты
с тем же числом атомов углерода.
В зависимости от
условий каталитическим окислением воздухомциклогексана получают циклогексанол, циклогексанон или
адипиновую кислоту
При действии сильных окислителей (KMnO4, K2Cr2O7 и др.)
циклоалканы образуют двухосновные карбоновые кислоты с тем
же числом атомов углерода:
Циклоалканы
Слайд 14
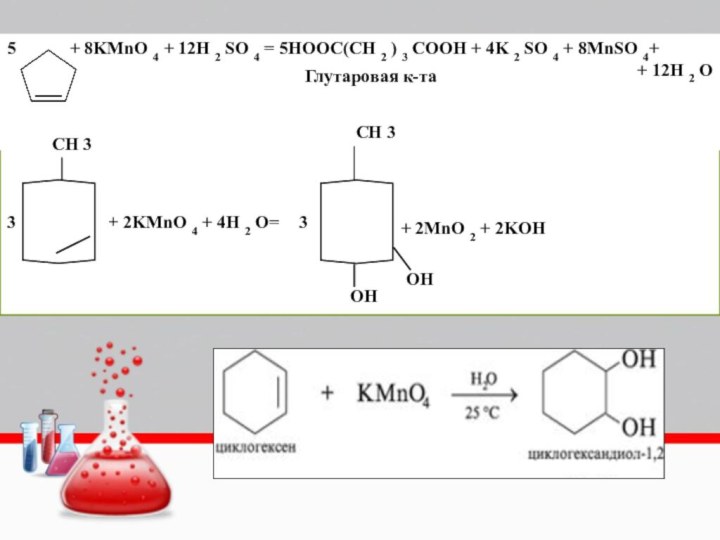
+2 KMnO4+3H2SO4=HOOC-(CH2)2-COOH+2MnSO4+K2SO4+2H2O
Янтарная к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)3-COOH+2MnSO4+K2SO4+4H2O
глутаровая к-та
+2 KMnO4+3H2SO4=HOOC-(CH2)4-COOH+2MnSO4+K2SO4+4H2O
Циклогексан окисляется до
адипиновой кислоты, используемой в производстве полиамидных волокон – капрона
и нейлона+O2→
+H2O
kat
Слайд 15
5 + 8KMnO
4 + 12H 2 SO 4 = 5HOOC(CH 2
) 3 COOH + 4K 2 SO 4 + 8MnSO 4++ 12H 2 O
Глутаровая к-та
CH 3
+ 2KMnO 4 + 4H 2 O=
3
CH 3
OH
OH
3
+ 2MnO 2 + 2KOH
Слайд 16
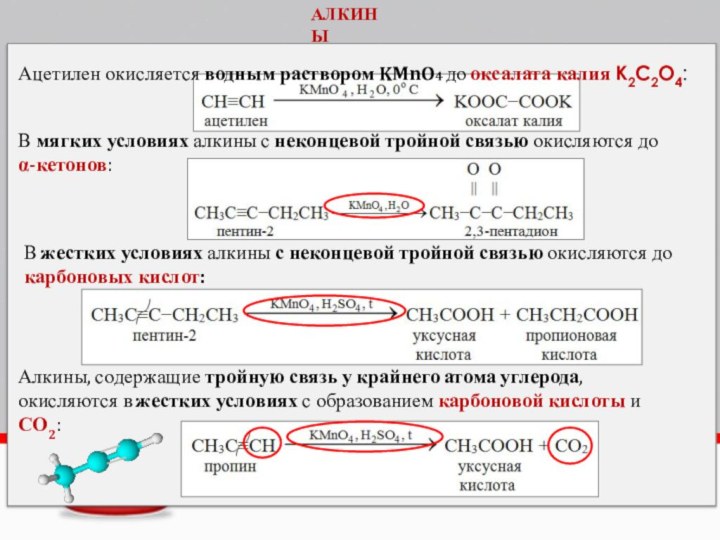
Ацетилен окисляется водным раствором KMnO4 до оксалата калия
K2C2O4:
АЛКИНЫ
В мягких условиях алкины с неконцевой тройной связью окисляются
доα-кетонов:
В жестких условиях алкины с неконцевой тройной связью окисляются до карбоновых кислот:
Алкины, содержащие тройную связь у крайнего атома углерода,
окисляются в жестких условиях с образованием карбоновой кислоты и
СО2:
Слайд 17
+H2O2=
Можно окислить озоном с образованием
диальдегида:
Бензол
Устойчив к окислителям при комнатной температуре
Не реагирует с водными
растворами KMnO4, K2Cr2O7 и других окислителей2
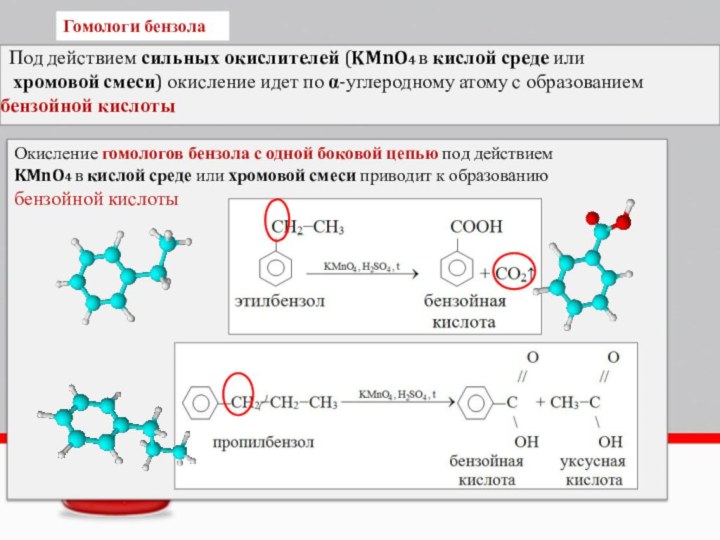
Слайд 18 Более сильные окислители – KMnO4 в кислой среде
или хромовая смесь при нагревании окисляют метильную группу до
карбоксильной:В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль - бензоат калия:
Окисляются относительно легко
Окислению подвергается боковая цепь
Мягкие окислители (MnO2) окисляют метильную группу
до альдегидной группы:
бензальдегид
Гомологи бензола
С6Н5СН3 + MnO2 →C6H5− CОН
Слайд 19
Под действием сильных окислителей (KMnO4 в кислой
среде или
хромовой смеси) окисление идет по α-углеродному
атому с образованием бензойной кислотыГомологи бензола
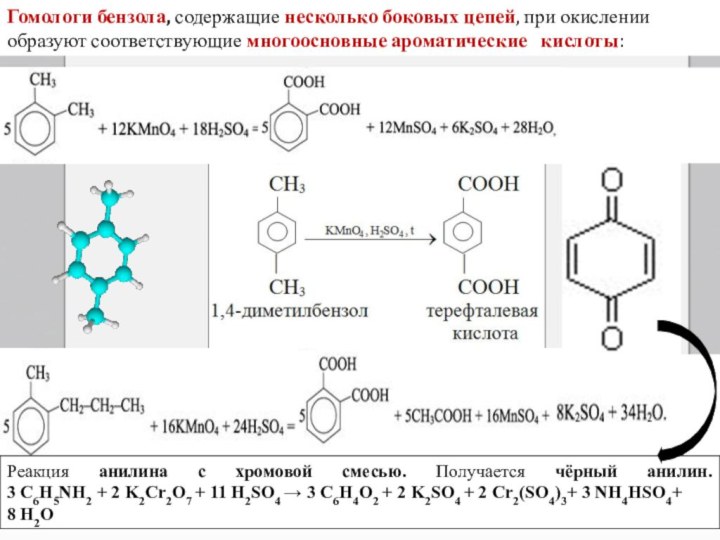
Слайд 20
Реакция анилина с хромовой смесью. Получается чёрный анилин.
3
C6H5NH2 + 2 K2Cr2O7 + 11 H2SO4 → 3 C6H4O2 + 2 K2SO4 +
2 Cr2(SO4)3+ 3 NH4HSO4+8 H2O
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты:
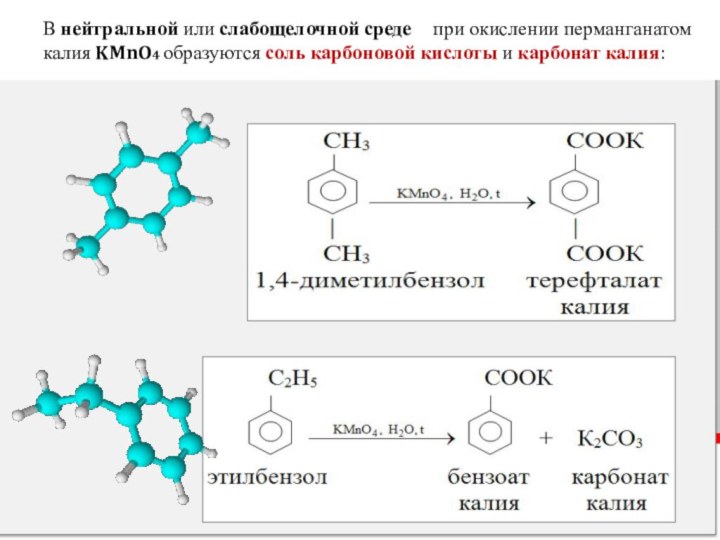
Слайд 21 В нейтральной или слабощелочной среде
при окислении перманганатом калия KMnO4 образуются соль
карбоновой кислоты и карбонат калия:
Слайд 23
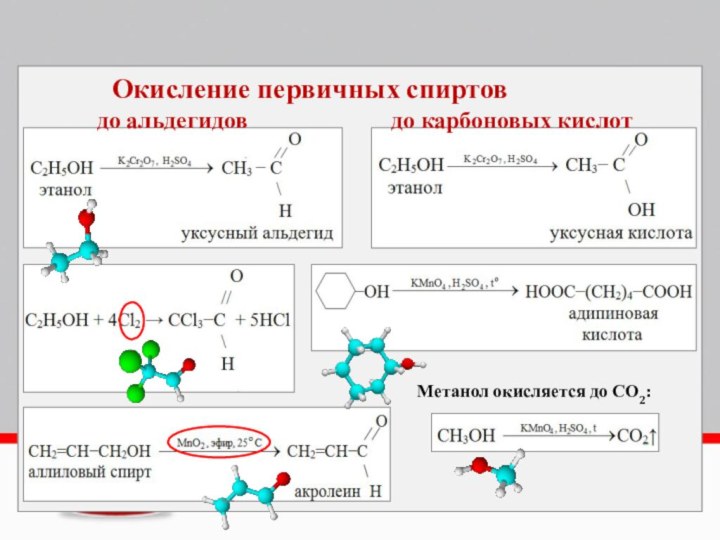
Окисление предельных одноатомных спиртов
Непосредственным продуктом окисления первичных спиртов
являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении
спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Слайд 24 Для окисления вторичных спиртов наиболее часто используют бихромат
калия в кислой среде при комнатной температуре или небольшом
нагревании. Применяют также KMnO4 и MnO2.Для окисления первичных спиртов до альдегидов обычно используют реактив Джонсона или комплекс CrO3 c пиридином. Перманганат калия не применяют для окисления спиртов в альдегиды, т.к. реакция не останавливается на стадии образования альдегида, и окисление идет дальше до кислоты. Однако широкое применение нашел MnO2. Этот реагент не затрагивает кратные связи, поэтому может быть использован для получения и непредельных альдегидов и кетонов:
Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Но если в третичном спирте у атома углерода, соседнего с С-ОН-группой, есть атом водорода, то такие спирты окисляются в кислой среде, с отщеплением воды, образованием в качестве промежуточного продукта алкена и разрывом С-С -связи:
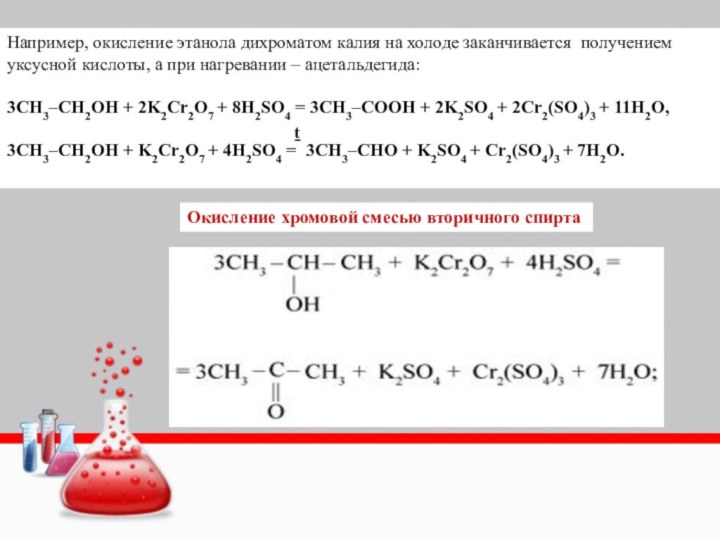
Слайд 25 Например, окисление этанола дихроматом калия на холоде заканчивается
получением уксусной кислоты, а при нагревании – ацетальдегида:
3CH3–CH2OH + 2K2Cr2O7 +
8H2SO4 = 3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O,3CH3–CH2OH + K2Cr2O7 + 4H2SO4 = 3CH3–CHO + K2SO4 + Cr2(SO4)3 + 7H2O.
ṯ
Окисление хромовой смесью вторичного спирта
Слайд 26
5CH3-CH2-OH+4KMnO4+6H2SO4=5CH3COOH+2K2SO4+4MnSO4+11H2O
CH3-CH2-OH+4KMnO4+5KOH= CH3COOK+4K2MnO4+4H2O
3CH3-CH2-OH+4KMnO4=3 CH3COOK+4MnO2+KOH+4H2O
Окислителем одноатомных спиртов может быть перекись
водорода
CH3-CH2-OH+2H2O2= CH3–COOH+3H2O
Окисление предельных одноатомных спиртов
+ 4K2Cr2O7 + 16H2SO4 = 3HOOC-(CH2)4-COOH + 4Cr2(SO4)3 + 4K2SO4 +19H2OОкисление циклогексанола до адипиновой кислоты
Слайд 27
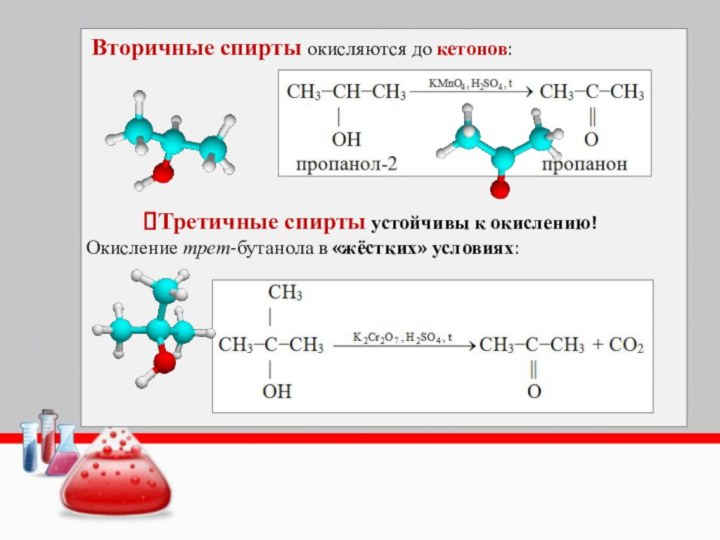
Вторичные спирты окисляются до кетонов:
Третичные спирты устойчивы к
окислению!
Окисление трет-бутанола в «жёстких» условиях:
Слайд 28
Окисление гликолей
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в
кислой среде с раствором KMnO4 или K2Cr2O7 легко окисляется
до щавелевой кислоты, а в нейтральной – до оксалата калия.5СН2(ОН) – СН2(ОН) + 8КMnO4+12H2SO4→5HOOC – COOH +8MnSO4 +4К2SO4 + +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→3KOOC – COOK +8MnO2 +2КОН +8Н2О
Глицерин, такими сильными окислителями как КMnO4 и K2Cr2O7, может окисляться до CO2 и H2O:
14 КMnO4+ 3C3H5(OH)3→7K2CO3+14MnO2+12H2O+2CO2
3C3H5(OH)3+7 K2Cr2O7-+28H2SO4→9 CO2+40 H2O+7K2SO4+7Cr2(SO4)3
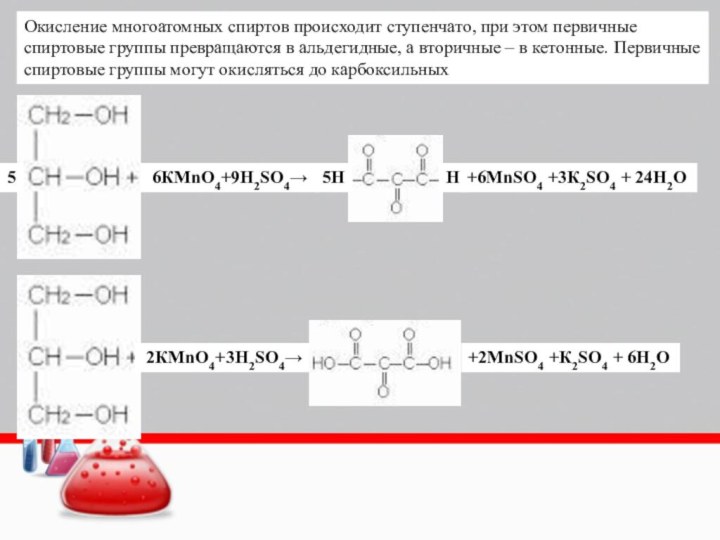
Слайд 29
6КMnO4+9H2SO4→
5
5H
H
+6MnSO4 +3К2SO4 + 24Н2О
Окисление многоатомных спиртов происходит
ступенчато, при этом первичные спиртовые группы превращаются в альдегидные,
а вторичные – в кетонные. Первичные спиртовые группы могут окисляться до карбоксильных 2КMnO4+3H2SO4→
+2MnSO4 +К2SO4 + 6Н2О
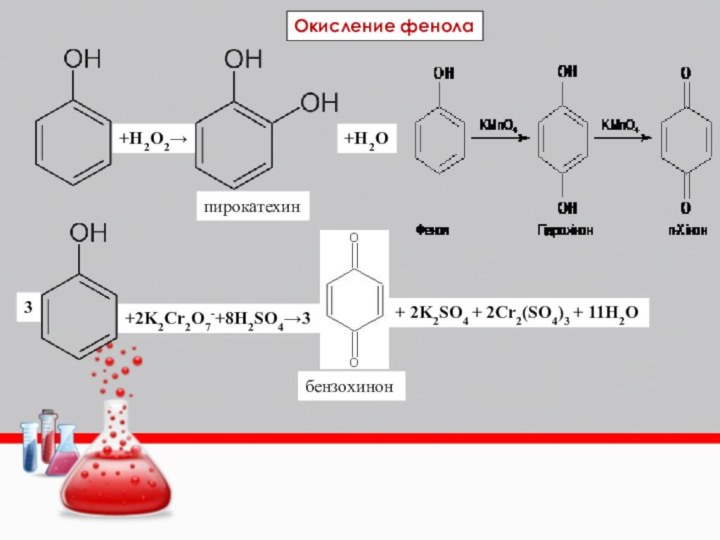
Слайд 31
+H2O2→
+H2O
Окисление фенола
пирокатехин
3
+2K2Cr2O7-+8H2SO4→3
+ 2K2SO4 + 2Cr2(SO4)3 + 11H2O
бензохинон
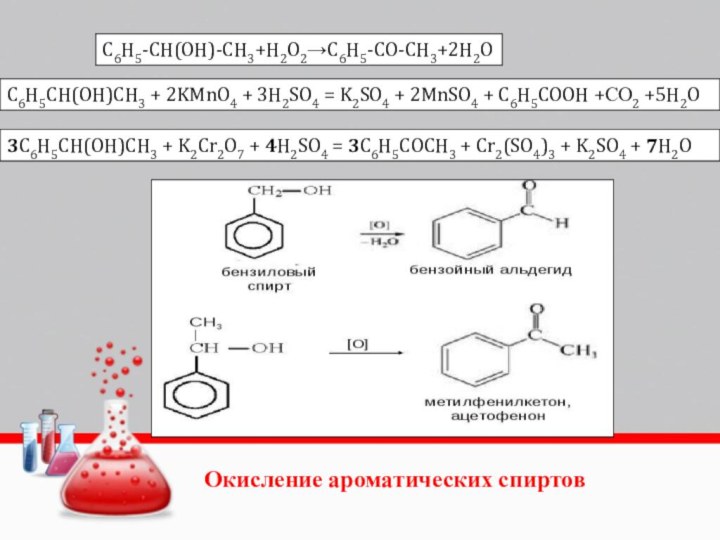
Слайд 32
C6H5-CH(OH)-CH3+H2O2→C6H5-CO-CH3+2H2O
C6H5CH(OH)CH3 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + C6H5COOH +СО2 +5H2O
3C6H5CH(OH)CH3 + K2Cr2O7 + 4H2SO4 = 3C6H5COCH3 + Cr2(SO4)3 + K2SO4 + 7H2O
Окисление ароматических спиртов
Слайд 33
Альдегиды легко окисляются до карбоновых кислот
Ароматические альдегиды
легко окисляются
даже кислородом воздуха
Метаналь окисляется до CО2
Окисление альдегидов и кетонов
Слайд 34
Качественные реакции на альдегиды
Окисление гидроксидом меди(II)
Реакция «серебряного зеркала»
Соль,
а не кислота!
Слайд 35
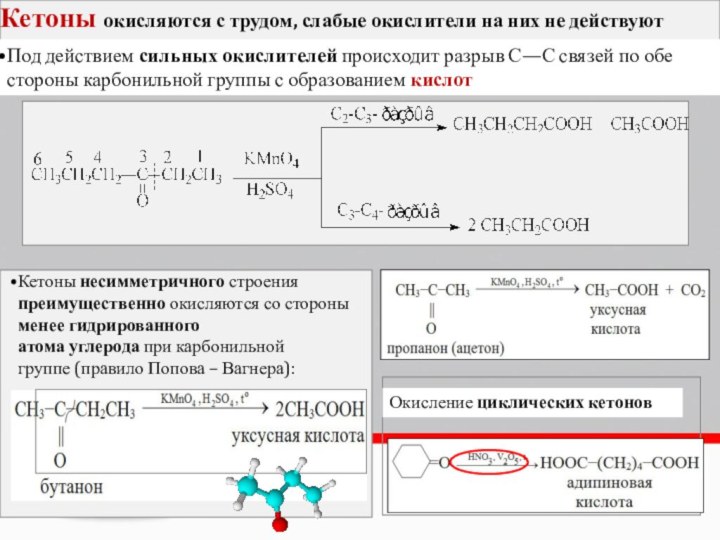
Кетоны окисляются с трудом, слабые окислители на них
не действуют
Под действием сильных окислителей происходит разрыв С—С связей
по обе стороны карбонильной группы с образованием кислот Кетоны несимметричного строения преимущественно окисляются со стороны менее гидрированного
атома углерода при карбонильной
группе (правило Попова – Вагнера):
Окисление циклических кетонов
Слайд 36
Окисление альдегидов
5CH3–CH=O + 2KMnO4 + 3H2SO4 = 5CH3–COOH + 2MnSO4 + K2SO4 +
3H2O,
3CH3CH=O + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2
+ H2O 3CH3CH=O + KMnO4+2KOH= CH3COOK+ K2MnO4+ H2O
5H–CH=O + 4KMnO4 + 6H2SO4 = 5CO2+ 4MnSO4 + 2K2SO4 + 11H2O
3H–CH=O + 4KMnO4 + 2KOH= 3K2CO3 +4MnO2 + 4H2O
3CH3–CH=O + K2Cr2O7 + 4H2SO4 = 3CH3–COOH + Cr2(SO4)3 + K2SO4 + 4H2O,
CH3–CH=O + 2[Ag(NH3)2]OH = CH3–COONH4 + 2Ag + 3NH3 + H2O
HCOH+ 2[Ag(NH3)2]OH =(NH4)2CO3+ 2Ag+ 2NH3 + H2O
CH3–CH=O + 2Cu(OH)2 = CH3COOH + Cu2O + 2H2O
CH3CH=O + Br2 + 3NaOH → CH3COONa + 2NaBr + 2H2O
Слайд 37
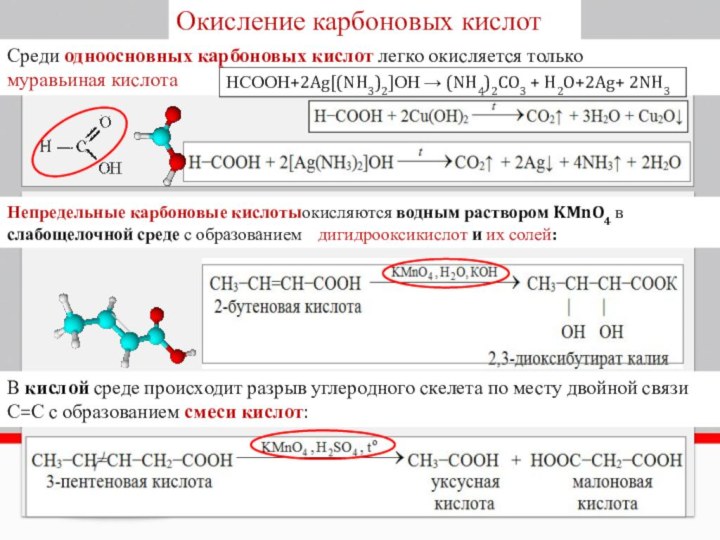
Окисление карбоновых кислот
Непредельные карбоновые кислотыокисляются водным раствором KMnO4
в слабощелочной среде с образованием дигидрооксикислот и их
солей:В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот:
Среди одноосновных карбоновых кислот легко окисляется только
муравьиная кислота
НСООН+2Ag[(NH3)2]ОН → (NH4)2CO3 + H2O+2Ag+ 2NH3
Слайд 38
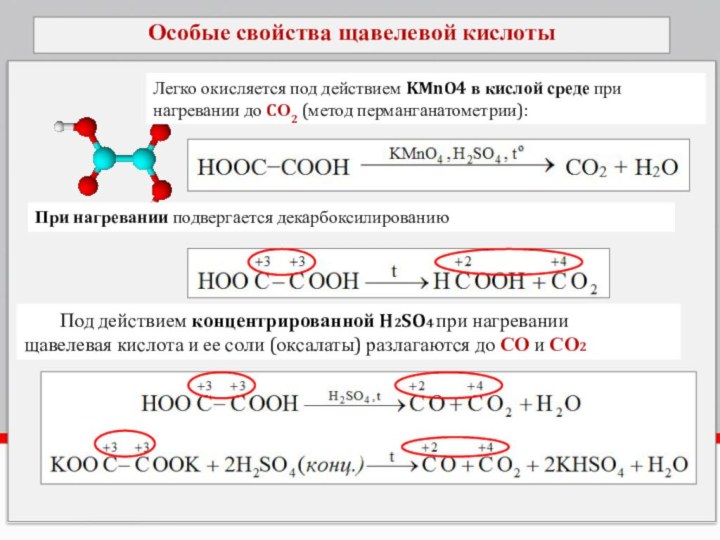
Особые свойства щавелевой кислоты
Легко окисляется под действием KMnO4
в кислой среде при нагревании до CО2 (метод перманганатометрии):
При
нагревании подвергается декарбоксилированию Под действием концентрированной H2SO4 при нагревании
щавелевая кислота и ее соли (оксалаты) разлагаются до СО и СО2
Слайд 39
Окисление карбоновых кислот
Среди кислот сильными восстановительными свойствами обладают
муравьиная и щавелевая, которые окисляются до углекислого газа.
5НСООН
+ 2KMnO4 + 3H2SO4= 5CO2+ 2MnSO4 + K2SO4 + 8H2O3НСООН + 2KMnO4 + 4KOH= 3K2CO3 +2MnO2 + 5H2O
5НOOC-СООН + 2KMnO4 + 3H2SO4= 10CO2+ 2MnSO4 + K2SO4 + 8H2O
НСООН + HgCl2 = CO2 + Hg + 2HCl
HCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
НСООН + 2[Ag(NH3)2]OH → NH4HCО3 +3NH3↑+ Н2O +2Ag↓
НСООН + 2Cu(OH)2 → CO2 + Cu2O↓ + 3H2O
Слайд 40
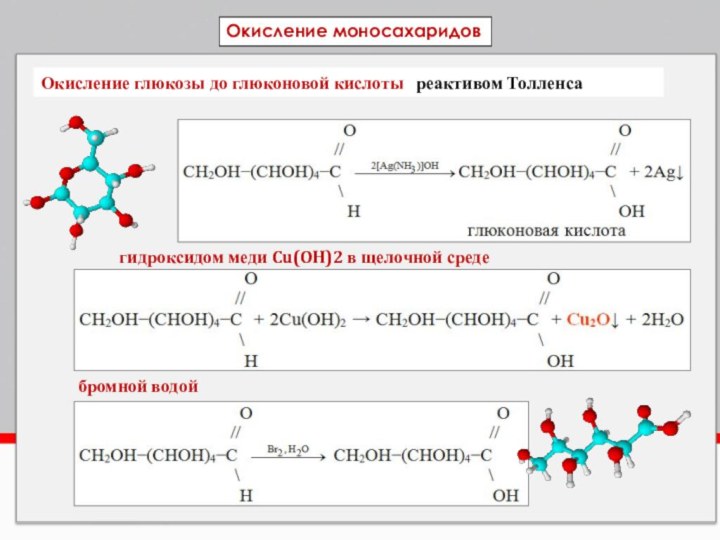
Окисление глюкозы до глюконовой кислоты реактивом Толленса
гидроксидом
меди Cu(OH)2 в щелочной среде
бромной водой
Окисление моносахаридов
Слайд 41
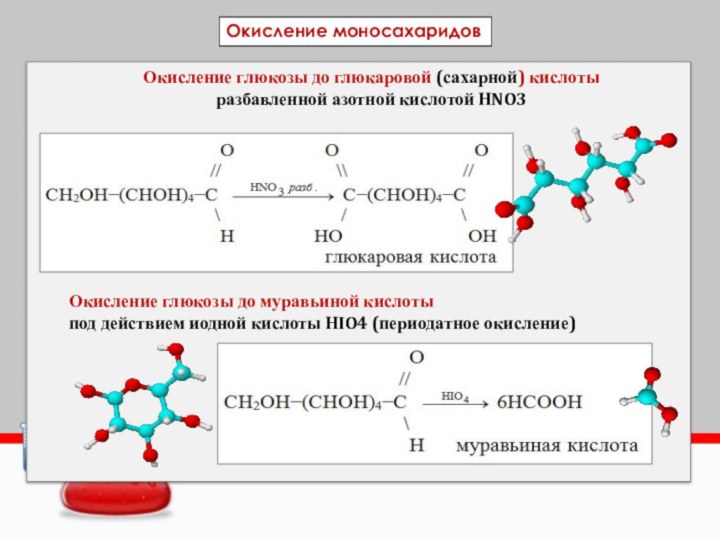
Окисление глюкозы до глюкаровой (сахарной) кислоты
разбавленной азотной кислотой
HNO3
Окисление глюкозы до муравьиной кислоты
под действием иодной кислоты HIO4
(периодатное окисление)Окисление моносахаридов