- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Классификация химических реакций 8 класс
Содержание
- 2. Химические реакции - это процессы, в результате которых изодних веществобразуютсядругие, отличающиесяот них по составу и строению
- 3. КлассификацияПо числу и составу реагирующих веществПо изменению
- 4. По числу и составу реагирующих веществРеакции, идущие без изменения состава веществРеакции, идущие с изменением состава вещества
- 5. По изменению степени окисленияОкислительно-восстановительныеРеакции, идущие без изменения степеней окисления химических элементов
- 6. По тепловому эффектуЭкзотермическиеЭндотермические
- 7. По агрегатному состоянию реагирующих веществГомогенныеГетерогенные
- 8. По участию катализатораКаталитическиеНекаталитические
- 9. По направлениюНеобратимыеОбратимые
- 10. Получение аллотропных модификаций C (графит)
- 11. С изменением составаСоединенияРазложенияЗамещенияОбмена
- 12. Реакции соединения – из двух и
- 13. Реакции разложения – из одного вещества
- 14. Реакции замещения – атомы простого вещества замещают
- 15. Реакции обмена – вещества обмениваются своими составными
- 16. Окислительно-восстановительные реакции 0 0
- 17. Реакции протекающие без изменения степени окисления
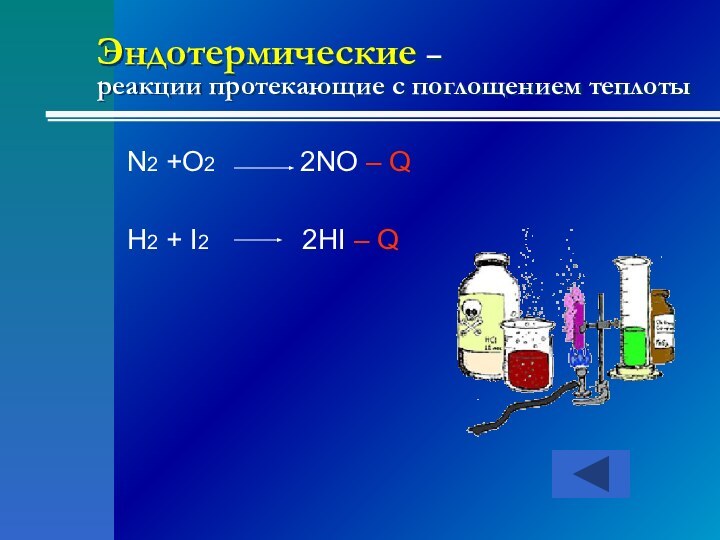
- 18. Экзотермические - реакции протекающие с выделением
- 19. Эндотермические – реакции протекающие с поглощением
- 20. Гомогенные – реакции в которых исходные вещества
- 21. Гетерогенные - реакции в которых исходные вещества
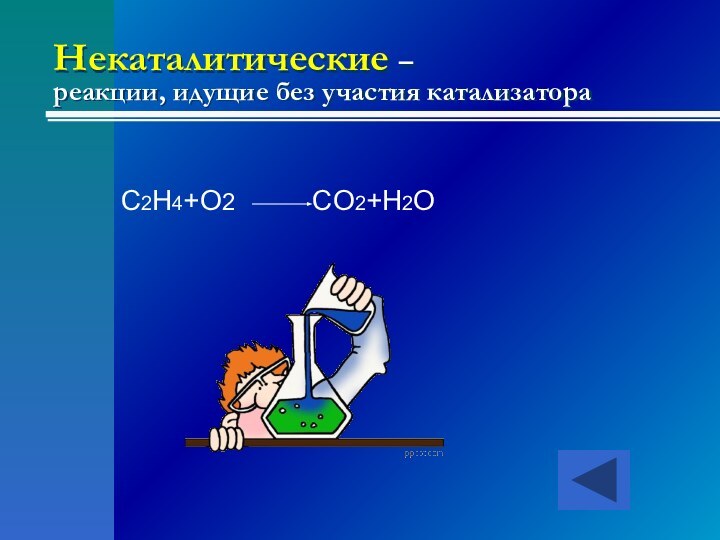
- 22. Каталитические – реакции, идущие с участием
- 23. Некаталитические – реакции, идущие без участия катализатораC2H4+O2 CO2+H2O
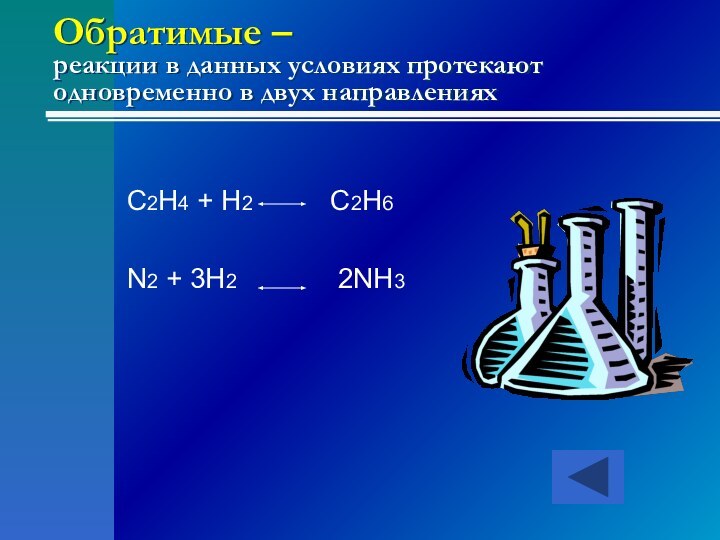
- 24. Обратимые – реакции в данных условиях
- 25. Необратимые – реакции в данных условиях
- 26. Составим характеристику процесса синтеза аммиака 0
- 27. Скачать презентацию
- 28. Похожие презентации
Химические реакции - это процессы, в результате которых изодних веществобразуютсядругие, отличающиесяот них по составу и строению
























Слайд 3
Классификация
По числу и составу реагирующих веществ
По изменению степени
окисления химических элементов, образующих вещества
По тепловому эффекту
По агрегатному состоянию
реагирующих веществПо участию катализатора
По направлению
Слайд 4
По числу и составу реагирующих веществ
Реакции, идущие без
изменения состава веществ
Реакции, идущие с изменением состава вещества
Слайд 5
По изменению
степени окисления
Окислительно-восстановительные
Реакции, идущие без изменения степеней
окисления химических элементов
Слайд 12 Реакции соединения – из двух и более веществ
образуется одно более сложное
2H2 + O2
2H2O2Na + Cl2 2NaCl
Решить:
Ca + O2
Na + S
H2 + Br2
Слайд 13 Реакции разложения – из одного вещества образуется два
и более
2HgO 2Hg
+ O22KNO3 2KNO2 + O2
Решить:
Fe(OH)2
MgCO3
Слайд 14 Реакции замещения – атомы простого вещества замещают атомы
в сложном веществе
Mg + 2HCl
MgCl2 + H2Zn + CuSO4 ZnSO4 + Cu
Решить:
Zn + H2SO4
CuO + H2
Слайд 15
Реакции обмена – вещества обмениваются своими составными частями
CO2+Ca(OH)2
CaCO3 +H2O
K2S + 2HCl
H2S + 2KClNaOH + HNO3 NaNO3 + H2O
Решить:
KOH + HCl
AgNO3 + HCl
MgCl2 + K2CO3
Слайд 16
Окислительно-восстановительные реакции
0 0
+4 -2
C + O2 CO2
0 +4
C – 4e C
восстановитель процесс окисления
0 - 2
O2 + 4e 2O
окислитель процесс восстановления
Решить:
Mg + O2
Слайд 17
Реакции протекающие без изменения
степени окисления
+ -2 +
-2 + -2 +Li2O + H2O 2LiOH
+2 +4 -2 +2 -2 +4 -2
CaCO3 CaO + CO2
Решить:
Na2O + H2O
Cu(OH)2
Слайд 18
Экзотермические -
реакции протекающие с выделением теплоты
4P
+ 5O2 2P2O5 +
QCH4+2O2 CO2+2H2O + Q
Слайд 20 Гомогенные – реакции в которых исходные вещества и
продукты реакции находятся в одном агрегатном состоянии
H2 (г) +
F2(г) 2HF(г)Fe(т) + S(т) FeS (т)
Слайд 21 Гетерогенные - реакции в которых исходные вещества и
продукты реакции находятся в разных агрегатных состояниях
Ca(т) + 2H2O(ж)
Ca(OH)2(р-р) +H2(г)Слайд 24 Обратимые – реакции в данных условиях протекают одновременно
в двух направлениях
C2H4 + H2
C2H6N2 + 3H2 2NH3
Слайд 25 Необратимые – реакции в данных условиях протекают только
в одном направлении
H2SO4+BaCl2 BaSO4
+ 2HCl2Na+2H2O 2NaOH+H2
Слайд 26
Составим характеристику процесса синтеза аммиака
0
0 Fe – 3 +
N2 (г) + 3H2 (г) NH3 (г) + Q
Реакция:
Соединения
Окислительно-восстановительная
Экзотермическая
Обратимая
Каталитическая
Гетерогенная