Слайд 2
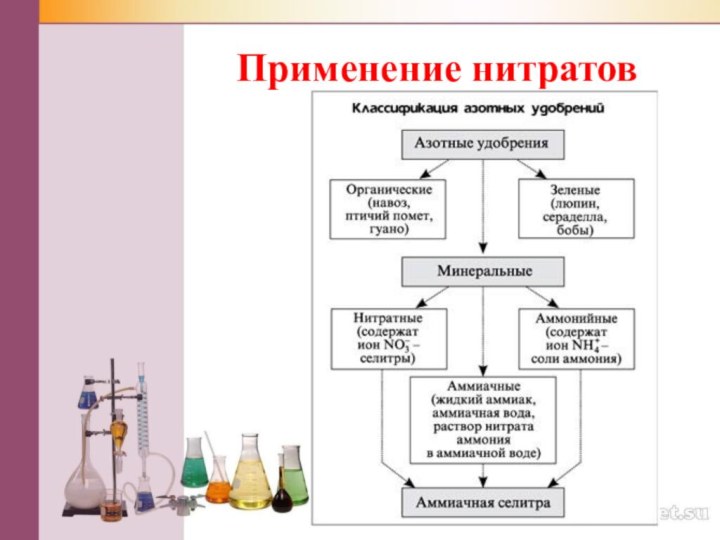
Нитраты (селитры)
Азотная кислота – одноосновная, образует один ряд
солей – нитраты состава:
Me(NO3)n и NH4NO3
KNO3 – нитрат калия (индийская селитра),
NаNО3 – нитрат натрия (чилийская селитра),
Са(NО3)2 – нитрат кальция (норвежская селитра),
NH4NO3 – нитрат аммония (аммиачная или
аммонийная селитра)
Слайд 3
Физические свойства
Нитраты – вещества с
преимущественно ионным типом кристаллических решёток. При обычных условиях это
твёрдые кристаллические вещества, все нитраты хорошо растворимы в воде, сильные электролиты.
Слайд 4
Получение нитратов
1) Металл + Азотная кислота
Cu + 4HNO3(k)
= Cu(NO3)2 + 2NO2↑ + 2H2O
2) Основный оксид + Азотная кислота
CuO + 2HNO3 = Cu(NO3)2 + H2O
3)
Основание + Азотная кислота
HNO3 + NaOH = NaNO3 + H2O
4) Аммиак + Азотная кислота
NH3 + HNO3 = NH4NO3
5) Соль слабой кислоты + Азотная кислота
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2 ↑
Слайд 5
Получение нитратов
6) Оксид азота (IV) + щёлочь
2NO2 + NaOH
= NaNO2 + NaNO3 + H2O
в присутствии кислорода -
4NO2 + O2 + 4NaOH = 4NaNO3 +
2H2O
Слайд 6
Химические свойства нитратов
I. Общие с другими солями
1) C металлами
Металл, стоящий
в ряду активности левее, вытесняет последующие из их солей:
Cu(NO3)2 +
Zn = Cu + Zn(NO3)2
2) С кислотами
AgNO3 + HCl = AgCl↓ + HNO3
3) Со щелочами
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
4) C cолями
2AgNO3 + BaCl2 = Ba(NO3)2 + 2AgCl↓
Слайд 7
II. Специфические
Все нитраты термически неустойчивы.
При нагревании они разлагаются с образованием кислорода.
Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений:
Слайд 8
1) Нитраты щелочных (исключение - нитрат лития) и
щелочноземельных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2КNO3 = 2KNO2 + O2
Слайд 9
3) Нитраты наименее активных металлов (правее меди) разлагаются до
металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag
+ 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Слайд 10
Исключения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
Слайд 11
Качественная реакция на нитрат-ион NO3–
Взаимодействие нитратов
c металлической медью при нагревании в присутствии концентрированной серной
кислоты или с раствором дифениламина в Н2SO4 (конц.). КNO3 (кр.) + Н2SO4 (конц.) = КНSО4 + НNО3↑
Слайд 13
Задача
Какова массовая доля азота в жидком аммиаке и
аммиачной селитре?
Решение
Формула аммиака – NH3.
Массовая доля азота в аммиаке:
W
(N) = Ar(N)/Mr(NH3)•100%,
W (N) = 14/17•100% = 82%.
Формула аммиачной селитры – NH4NO3.
Массовая доля азота в аммиачной селитре:
W(N) = 2Ar(N)/Mr(NH4NO3)•100%,
W(N) = 2•14/80•100% = 35%.
Слайд 14
Нитраты в производстве взрывчатых веществ
Многие взрывчатые смеси содержат
в своем составе окислитель (нитраты металлов или аммония и
др.) и горючее (дизельное топливо, алюминий, древесную муку). Поэтому соли – нитрат калия, нитрат бария, нитрат стронция и другие – применяются в пиротехнике.
Азотное удобрение нитрат аммония вместе с алюминием и древесным углем входит в состав взрывчатой смеси – аммонала. Основная реакция, которая протекает при взрыве:
3NН4NО3 + 2Аl =3N2 ↑+ 6Н2О + Аl2O3 + Q.
Высокая теплота сгорания алюминия повышает энергию взрыва. Применение нитрата аммония в составе аммонала основано на его свойстве разлагаться при детонации с образованием газообразных веществ:
2NН4NО3 (кр.) = 2N2 ↑+ 4Н2О + O2↑
Порошкообразные металлы Zn, Мg, Al, cмешанные с нитратом серебра, используют в петардах.
Слайд 15
Черный или дымный порох – это смесь 75% нитрата
калия, 15% древесного угля и 10% серы.
Слайд 16
Применение нитратов и нитритов в медицине
Нитрат серебра AgNO3, который чернит
ткань, бумагу, парты и руки (ляпис), применяют как противомикробное
средство для лечения кожных язв, для прижигания бородавок и в качестве противовоспалительного средства при хроническом гастрите и язве желудка: пациентам назначают пить 0,05%-й раствор АgNO3.
Основный нитрат висмута Вi(ОН)2NО3 назначают внутрь при язвенной болезни желудка и двенадцатиперстной кишки в качестве вяжущего и антисептического средства. Наружно – в мазях, присыпках при воспалительных заболеваниях кожи.
Соль нитрит натрия NaNО2 применяют в медицине как спазмолитическое средство.