- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Кислоты: классификация, химические свойства (8 класс)
Содержание
- 2. Дайте определение кислот с точки зрения атомно-молекулярного учения,с позиций ТЭД…
- 3. 1.Класификация кислот.Агрегатное состояние (при обычных условиях) :
- 4. II. По наличию кислородаКислородсодержащие
- 5. III.Основность (число атомов водорода). 1. Одноосновные (
- 6. IV. Растворимость в воде 1. Растворимые
- 7. V. Летучесть 1. Летучие ( сероводородная, соляная,
- 8. VI. Степень электролитической диссоциации 1. Сильные ( серная, соляная, азотная). 2. Слабые ( сероводородная, сернистая, угольная).
- 9. VII. Стабильность.1. Стабильные (серная, фосфорная, соляная).2. Нестабильные (сернистая, угольная, кремневая).
- 10. 1) Кислота + металл = соль +
- 11. 2) Кислота + оксид металла = соль
- 12. 3) Кислота + основание = соль +
- 13. 4) к-та(1) + соль(1) = к-та(2) +
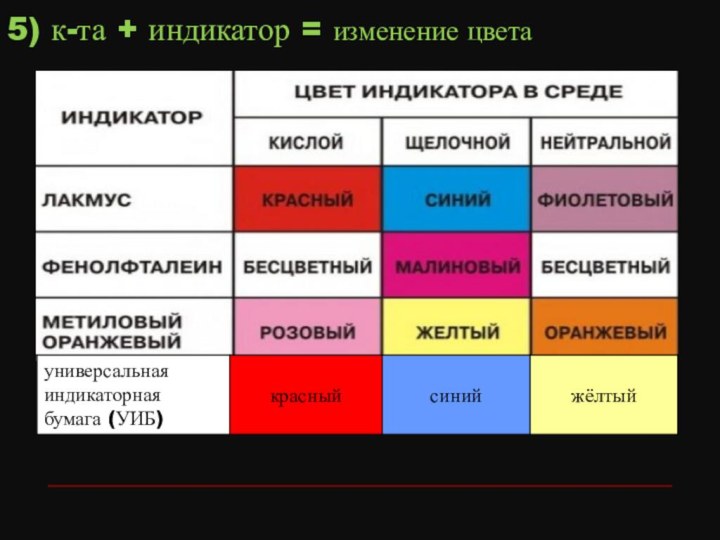
- 14. 5) к-та + индикатор = изменение цвета
- 15. Скачать презентацию
- 16. Похожие презентации
Дайте определение кислот с точки зрения атомно-молекулярного учения,с позиций ТЭД…












Слайд 3
1.Класификация кислот.
Агрегатное состояние (при обычных условиях) :
твёрдые (фосфорная, кремниевая),
(назовите формулы)жидкие (серная кислота),
(назовите формулы)
газообразные (хлороводород, бромоводород, сероводород), которые в водных растворах образуют кислоты.
Слайд 4
II. По наличию кислорода
Кислородсодержащие
(фосфорная, азотная).
Бескислородные (соляная, сероводородная).
(назовите формулы)
(назовите формулы)
Слайд 5
III.Основность (число атомов водорода).
1. Одноосновные ( соляная,
азотная).
2. Двухосновные
(сероводородная, серная).3. Трёхосновные (фосфорная).
(назовите формулы)
(назовите формулы)
Слайд 6
IV. Растворимость в воде
1. Растворимые
( серная, азотная, сероводородная).
2. Нерастворимые ( кремниевая).(назовите формулу)
(назовите формулы)
Слайд 7
V. Летучесть
1. Летучие ( сероводородная, соляная, азотная),
легко переходят в газообразное состояние, т.е. испаряются.
2. Нелетучие
( серная, кремниевая, фосфорная).
Слайд 8
VI. Степень электролитической диссоциации
1. Сильные ( серная,
соляная, азотная).
2. Слабые ( сероводородная, сернистая, угольная).
Слайд 9
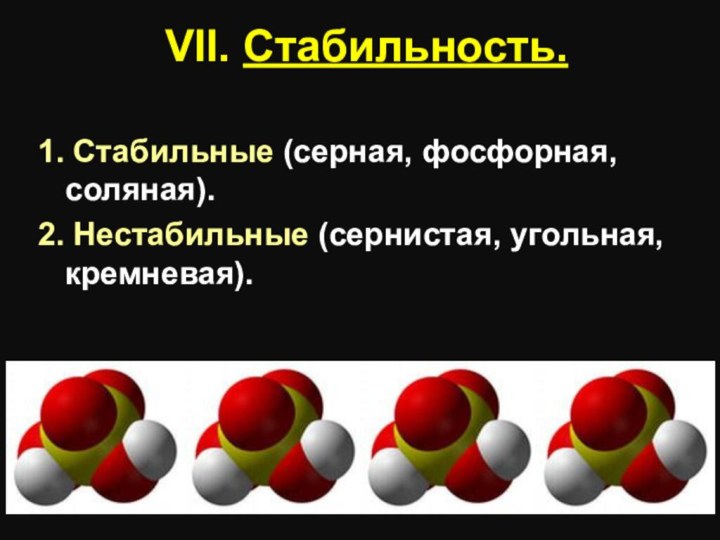
VII. Стабильность.
1. Стабильные (серная, фосфорная, соляная).
2. Нестабильные (сернистая,
угольная, кремневая).
Слайд 10 1) Кислота + металл = соль + H2
↑
(растворимая)Условия: а) металл стоит до водорода в ряду напряжения; б) в реакцию не вступают щелочные металлы (1группа гл. п/гр.); в) конц. кислоты ( серная, азотная) взаимодействуют по-особому
Zn + HCl = ZnCl2 + H2 ↑
2.Химические свойства кислот.
Слайд 11 2) Кислота + оксид металла = соль +
H2O
СuO + H2SO4 = CuSO4 +
H2Oсоставьте ионные ур-ия
3) Кислота + основание = соль + H2O
(реакция нейтрализация)
а) со щелочами – любые кислоты
H2S + NaOH = Na2S + H2O
составьте ионные ур-ия
Слайд 12
3) Кислота + основание = соль + H2O
(реакция
нейтрализация)
б) с нерастворимыми основаниями – сильные кислоты (соляная,
азотная, серная, бромоводородная), соль – образуется растворимаяHCl + Сu(OH)2 = СuCl2 + H2O
составьте ионные ур-ия
Слайд 13 4) к-та(1) + соль(1) = к-та(2) + соль(2)
Протекает в том случае, если:
а) выпадает осадок
H2SO4 + BaCl2 = BaSO4↓+ HCl
составьте ионные ур-ия
б) выделяется газ
HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2↑
составьте ионные ур-ия