- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Основания: классификация, свойства
Содержание
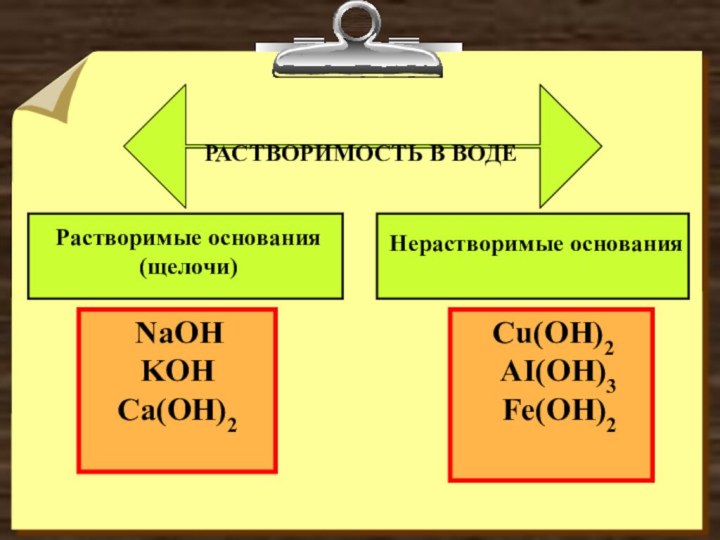
- 2. РАСТВОРИМОСТЬ В ВОДЕРастворимые основания(щелочи)Нерастворимые основания NaOH KOH Ca(OH)2 Cu(OH)2 AI(OH)3 Fe(OH)2
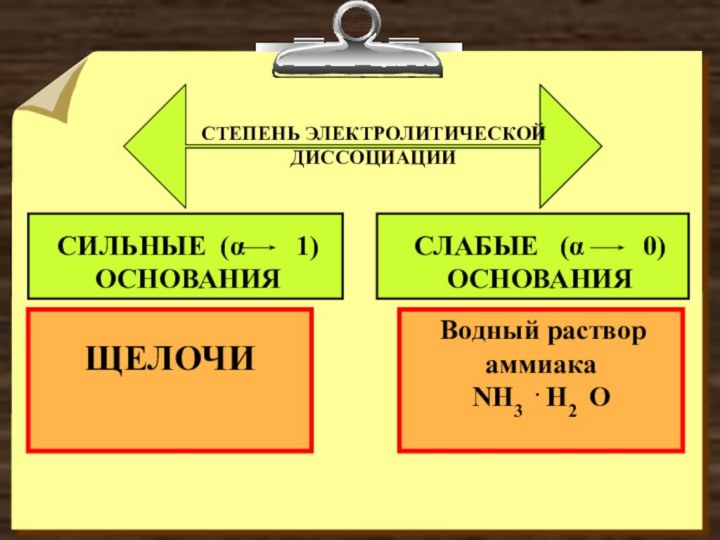
- 3. ЩЕЛОЧИ Водный раствор аммиакаNH3 . H2
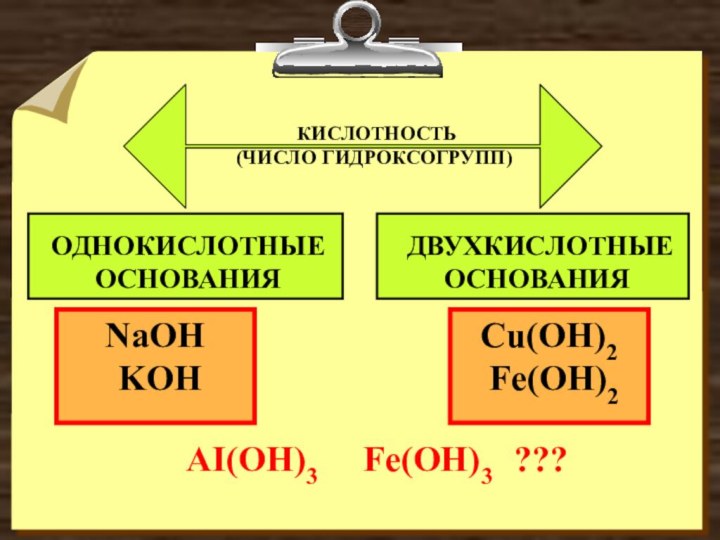
- 4. NaOH KOH Cu(OH)2 Fe(OH)2 КИСЛОТНОСТЬ
- 5. Гидроксид цезия – сильнейшее основаниеГидроксид натрия
- 6. Гидроксид кальция Гидроксид бария
- 7. Гидроксид железа (Ш)Гидроксид меди (II)
- 8. Гидроксид магнияГидроксид алюминия
- 9. ТИПИЧНЫЕ
- 10. Скачать презентацию
- 11. Похожие презентации
РАСТВОРИМОСТЬ В ВОДЕРастворимые основания(щелочи)Нерастворимые основания NaOH KOH Ca(OH)2 Cu(OH)2 AI(OH)3 Fe(OH)2







Слайд 3
ЩЕЛОЧИ
Водный раствор аммиака
NH3 . H2 O
CТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
СИЛЬНЫЕ (α
1)ОСНОВАНИЯ
СЛАБЫЕ (α 0)
ОСНОВАНИЯ
Слайд 4
NaOH
KOH
Cu(OH)2
Fe(OH)2
КИСЛОТНОСТЬ
(ЧИСЛО ГИДРОКСОГРУПП)
ОДНОКИСЛОТНЫЕ
ОСНОВАНИЯ
ДВУХКИСЛОТНЫЕ
ОСНОВАНИЯ
AI(OH)3 Fe(OH)3
???Слайд 9 ТИПИЧНЫЕ РЕАКЦИИ
ОСНОВАНИЙ
Основание + кислота → соль + вода.
(реакция обмена)NaOH + НСI = NaCI + H2O( реакция нейтрализации)
Cu(ОН)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2. Щелочь + оксид неметалла → соль + вода.
(реакция обмена)
2 NaOH + CO2 = Na2CO3 + H2O
3. Щелочь + соль → новое основание + новая соль.
(реакция обмена)
2KOH + CuSO4 = Cu(OH)2 ↓ + K2SO4