- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Фосфор
Содержание
- 2. Фосфор (лат. Phosphorus) - химический элемент V
- 3. Историческая справкаПо некоторым литературным данным, способ получения фосфора был известен еще арабским алхимикам 12 века.
- 4. Общепринятой датой открытия фосфора считается 1669 год,
- 5. Фосфор в природеСреднее содержание фосфора в земной
- 6. Известно около 180 минералов фосфора, в основном
- 7. Физические свойства фосфораФосфор существует в виде нескольких
- 8. Белый фосфор Воскообразное, прозрачное вещество с характерным
- 9. Красный фосфорОбычный товарный красный фосфор практически полностью
- 10. Чёрный фосфорЧерный фосфор представляет собой кристаллы ромбической
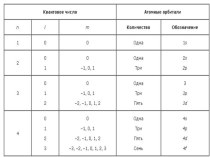
- 11. Химические свойства фосфораКонфигурация внешних электронов атома фосфора
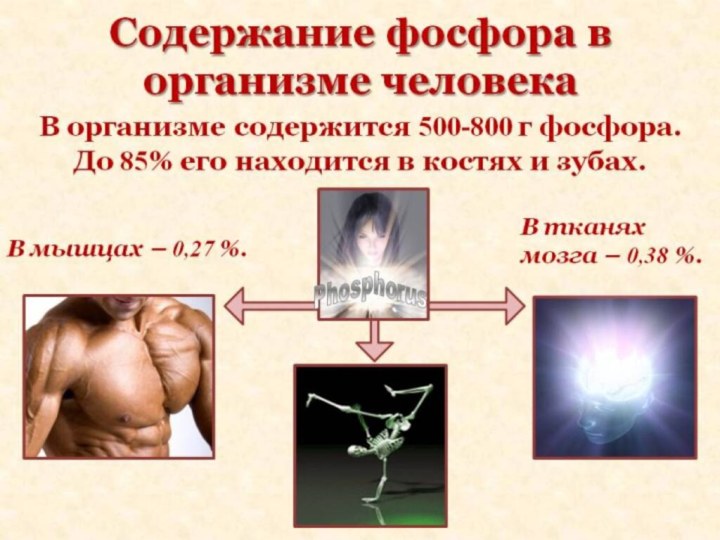
- 13. Фосфор в организмеФосфор - один из важнейших
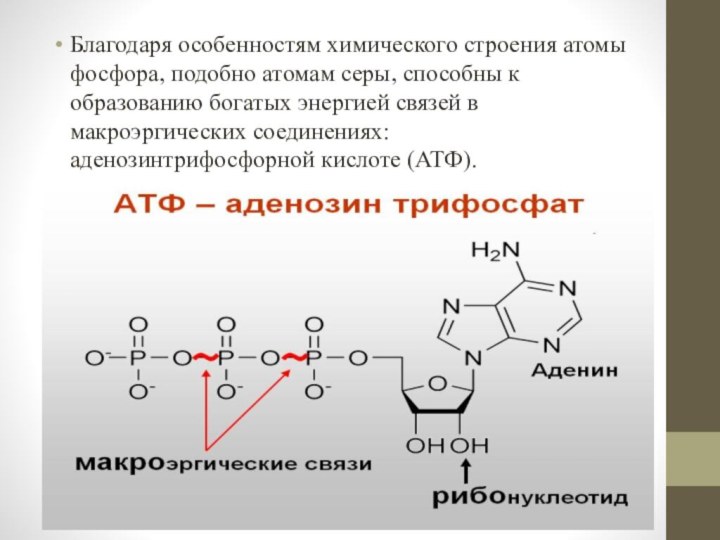
- 15. Благодаря особенностям химического строения атомы фосфора, подобно
- 16. Содержание фосфора (в мг на 100 г
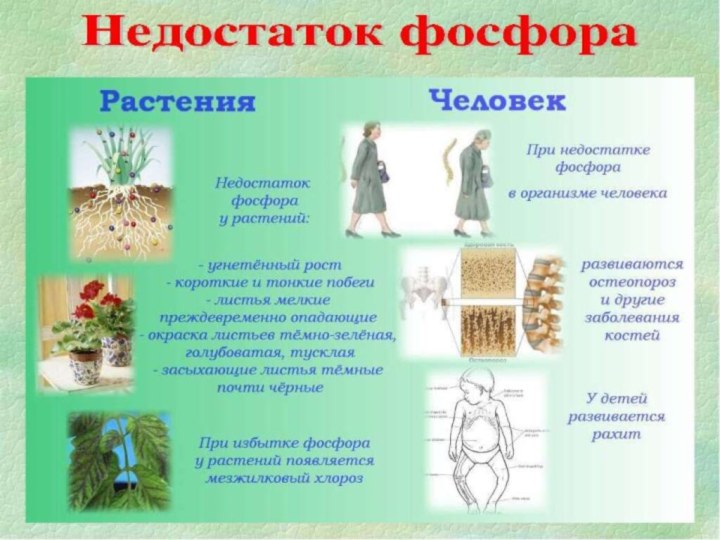
- 18. Недостаток фосфора в организме При недостатке фосфора
- 20. Фосфор в фармакологииТерапевтическое применение препаратов фосфора основано
- 21. Правильны ли следующие утверждения?Фосфор – это элемент
- 22. 9) Фосфор может быть окислителем и восстановителем.10)
- 23. Скачать презентацию
- 24. Похожие презентации
Фосфор (лат. Phosphorus) - химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376, неметалл.



















Слайд 3
Историческая справка
По некоторым литературным данным, способ получения фосфора
был известен еще арабским алхимикам 12 века.
Слайд 4 Общепринятой датой открытия фосфора считается 1669 год, когда
X. Бранд (Германия) при прокаливании с песком сухого остатка
от выпаривания мочи и последующей перегонкой без доступа воздуха получил светящееся в темноте вещество, названное сначала "холодным огнем", а позднее фосфором от греч. phosphoros - светоносный
Слайд 5
Фосфор в природе
Среднее содержание фосфора в земной коре
(кларк) - 9,3·10-2% по массе.
Фосфор принимает участие в
магматических процессах и энергично мигрирует в биосфере. С обоими процессами связаны его крупные накопления, образующие промышленные месторождения апатитов и фосфоритов. Слайд 6 Известно около 180 минералов фосфора, в основном -
это различные фосфаты, из которых наиболее распространены фосфаты кальция.
Слайд 7
Физические свойства фосфора
Фосфор существует в виде нескольких аллотропических
модификаций, главные из которых - белая, красная и черная.
Слайд 8
Белый фосфор
Воскообразное, прозрачное вещество с характерным запахом,
образуется при конденсации паров фосфора.
Белый фосфор ядовит: на воздухе
при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой.
Слайд 9
Красный фосфор
Обычный товарный красный фосфор практически полностью аморфен;
имеет цвет от темно-коричневого до фиолетового.
Красный фосфор на
воздухе не самовоспламеняется, вплоть до температуры 240-250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и других.
Слайд 10
Чёрный фосфор
Черный фосфор представляет собой кристаллы ромбической структуры.
По внешнему виду черный фосфор похож на графит. Черный
фосфор малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
Слайд 11
Химические свойства фосфора
Конфигурация внешних электронов атома фосфора 3S²3P³;
в соединениях наиболее характерны степени окисления +5, +3, и
-3.Фосфор химически активен, наибольшей активностью обладает белый фосфор; красный и черный фосфор в химических реакциях гораздо пассивнее.
Окисление белого фосфора происходит по механизму цепных реакций
Слайд 13
Фосфор в организме
Фосфор - один из важнейших биогенных
элементов, необходимый для жизнедеятельности всех организмов.
Присутствует в живых
клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих коферментов и других органических соединений.Слайд 15 Благодаря особенностям химического строения атомы фосфора, подобно атомам
серы, способны к образованию богатых энергией связей в макроэргических
соединениях: аденозинтрифосфорной кислоте (АТФ).Слайд 16 Содержание фосфора (в мг на 100 г сухого
вещества) в тканях растений - 230-350, морских животных -
400-1800, наземных - 1700-4400, у бактерий - около 3000.
Слайд 18
Недостаток фосфора в организме
При недостатке фосфора в
организме у животных и человека развиваются остеопороз и другие
заболевания костей, у растений - фосфорное голодание.
Слайд 20
Фосфор в фармакологии
Терапевтическое применение препаратов фосфора основано на
том, что в малых дозах они усиливают рост и
развитие костной ткани (в растущем организме) , стимулируют кроветворение, обладают способностью тормозить окислительные процессы в организме и принимают участие в обмене веществ нервной и мышечной ткани.
Слайд 21
Правильны ли следующие утверждения?
Фосфор – это элемент пятой
группы, побочной подгруппы.
На последнем электронном слое атома фосфора содержится
3 электрона.Фосфор – это неметалл.
Фосфор существует в виде 2 аллотропных модификаций.
Фосфор – химически активен.
Наибольшей активностью обладает чёрный фосфор.
Белый фосфор – ядовит.
Белый фосфор на воздухе воспламеняется.
Слайд 22
9) Фосфор может быть окислителем и восстановителем.
10) При
взаимодействии фосфора с избытком кислорода образуется оксид трёхвалентного фосфора.
11)
При взаимодействии фосфора с металлами образуются фосфиды.12) Фосфор - биогенный элемент.
13) Больше всего фосфора находится в мышцах.
14) Фосфор влияет на обмен веществ в организме.