Слайд 2
Функции белков
1) структурная (пластическая, опорная) – определяет

структуру тела, входят в состав различных биологических мембран. Эта
функция является основной для коллагенов, эластинов, кератинов.
2) Каталитическая – белки обладают свойствами биокатализаторов (ферментов), ускоряя течение биологических процессов в организме.
3) Энергетическая – за счет части аминокислот. На долю белка приходится 10-20% энергопотребления.
4) Транспортная – белки переносят с кровью и другими биологическими жидкостями вещества, нерастворимые в воде (витамины, металлы, липиды, газы) и способствуют транспорту этих веществ через мембраны.
5) Защитная –
а) при поступлении чужеродного белка – антигена в организме вырабатываются антитела, образуется комплекс антиген-антитело и он исключается из метаболического круга путем осаждения, лизиса и т.д.
б) Гемостаз при травмах.
в) Связывание токсических веществ, поступивших извне или образовавшихся в результате метаболических реакций (например, альбумины плазмы крови связывают билирубин, СЖК, лекарства).
г) Антитела (гамма-глобулины, иммуноглобулины) д) интерфероны – блокируют синтез вирусных белков путем индукции синтеза ряда внутриклеточных ферментов.
Слайд 3
Функции белков
6) Сократительная – обеспечивает сокращение мышцы,
перистальтику и т.п.
7) Регуляторная – белки играют важную
роль в обменных процессах, осуществляют связь внутренней среды организма с внешней средой. Это гормоны, ферменты, БАВ, пептиды и т.д.). Рецепторы, через которые осуществляются регуляторные процессы также являются белками.
8) Трансформирующая – белки участвуют в превращении электрической и осмотической энергии в химическую энергию АТФ.
9) Передача наследственных признаков. Белки «запускают» процесс передачи наследственной информации и контролируют его на всем протяжении.
Кроме того, белки способствуют поддержанию стабильного онкотического давления, входят в состав буферных систем, поддерживающих рН внутренней среды и т.д.
Слайд 4
Классификация белков
Белки
Простые
гидролизуются
ТОЛЬКО
на аминокислоты
Сложные
при гидролизе
дают не
только
аминокислоты,
но и другие структуры –
ПРОСТЕТИЧЕСКИЕ группы
глобулярные
фибриллярные
фосфопротеиды
металлопротеиды
хромопротеиды
липопротеиды
Слайд 5
Простые белки
Глобулярные белки́
белки, в молекулах которых полипептидные цепи
плотно свёрнуты в компактные шарообразные структуры — глобулы (третичные
структуры белка)
Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями.
К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции
Слайд 6
Простые белки
Фибриллярные белки́
имеют вытянутую нитевидную структуру, в которой
соотношение продольной и поперечной осей более 1:10. Полипептидные цепи
многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
Большинство не растворяются в воде. К фибриллярным белкам относят например, α-кератины (на их долю приходится почти весь сухой вес волос, белки шерсти, рогов, копыт, ногтей, чешуи, перьев), коллаген — белок сухожилий и хрящей).
В формировании пространственной структуры участвуют, кроме слабых связей, ковалентные непептидные связи, тогда как в глобулярных белках основной вклад в стабилизацию конформации молекулы вносят слабые нековалентные взаимодействия.
Слайд 7
Фосфопротеиды - строение, представители, значение
Сложные белки, обособленной простетической
группы не имеют. Ее роль выполняют остатки фосфорной кислоты,
связанные сложноэфирными связями с гидроксильными группами оксиаминокислот: сер, тре, тир.
Полноценные белки с большой молекулярной массой, при нагревании не свертываются (термостабильны), в воде не растворимы, хорошо растворимы в разбавленных растворах солей и щелочей. Имеют кислый характер (ИЭТ ~ 4,7) из-за остатков фосфорной кислоты, осаждаются кислотами.
Служат пластическим материалом (источники незаменимых аминокислот и фосфора).
Представители – казеин молока, вителлин и фосвитин – ФП яичного желтка
Слайд 8
Хромопротеиды – строение, представители, значение
Окрашенные белки (chroma –
краска). Молекулы состоят из простого белка и простетической группы,
окрашенной обычно за счет металла или витамина. Среди ХП различают дыхательные белки и дыхательные ферменты, которые образуют подгруппу гемопротеидов. Кроме гемопротеидов в группу ХП входят пигменты (родопсин, меланин), магний-порфирины (хлорофилл), желтые ферменты – флавиновые ферменты (выполняют роль дыхательных ферментов).
К дыхательным белкам относятся гемоглобин (Нb) – красный пигмент крови и миоглобин (Мgb) – красный пигмент мышц.
Слайд 9
Гемоглобин состоит из простого белка типа гистонов –
глобина и 4-х гемов (простетическая группа). Глобин состоит из
2-х п/п альфа цепей (по 141 аминокислоте в каждой) и 2-х бета-цепей (по 146 аминокислот в каждой). Видовая специфичность гемоглобина обусловлена особенностями аминокислотного состава глобина. Глобин, соединяясь с гемом, превращает малорастворимую и инертную структуру в хорошо растворимую и активную форму, способную связывать кислород. В свою очередь гемы придают устойчивость большим молекулам глобина.
Хромопротеиды – строение, представители, значение
Слайд 10
Дыхательные ферменты. Это биологические катализаторы, ускоряющие ход ОВР
в клетках и тканях. это сложные белки, среди них
различают гемсодержащие (Цх, каталаза, пероксидазы) и негемовые (флавиновые ферменты). У первых простетической группой являются гемы различного строения, а у вторых – производные витамина В2 (рибофлавина).
Хромопротеиды – строение, представители, значение
Слайд 11
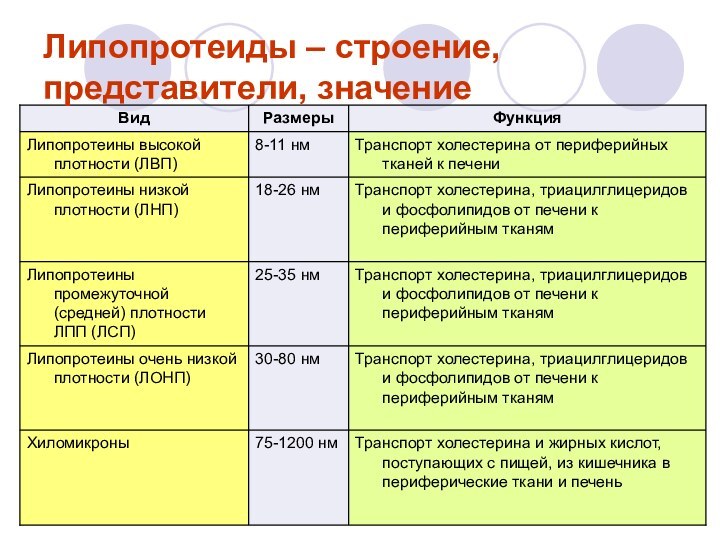
Липопротеиды – строение, представители, значение
класс сложных белков, простетическая
группа которых представлена каким-либо липидом. Так, в составе липопротеинов
могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Различают свободные (ЛП крови) и структурные ЛП (в составе мембран, ЭПР, органоидов). Свободные (сывороточные) ЛП построены по типу мицелл, т.е. имеют гидрофобное ядро. Ядро окружено гидрофильной оболочкой из белков и ФЛ.
Различают альфа-ЛП (ЛПВП), b-ЛП (ЛПНП), преb-ЛП (ЛПОНП), которые отличаются разным содержанием липидов и белка. ЛП – это транспортная форма липидов, в которых липиды становятся легко растворимыми в воде и легко переносятся кровью. Структурные ЛП построены иначе: внутри – белок, снаружи – липиды. Их функция тесно связана с метаболизмом клетки.
Слайд 12
Липопротеиды – строение, представители, значение
Слайд 13
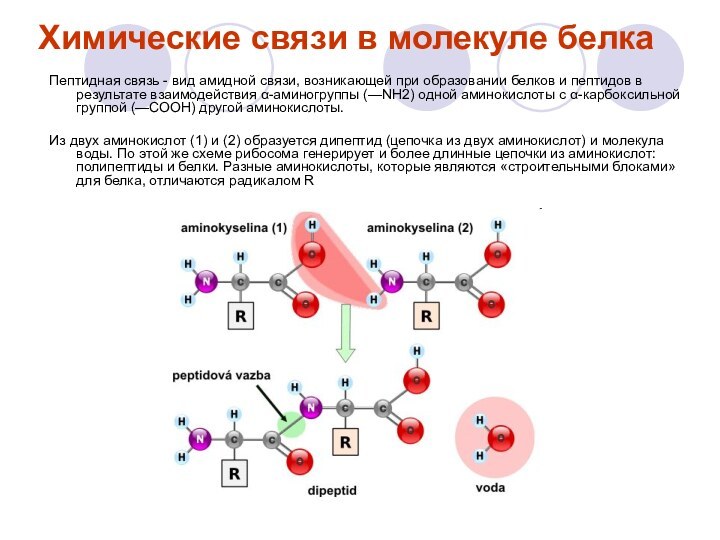
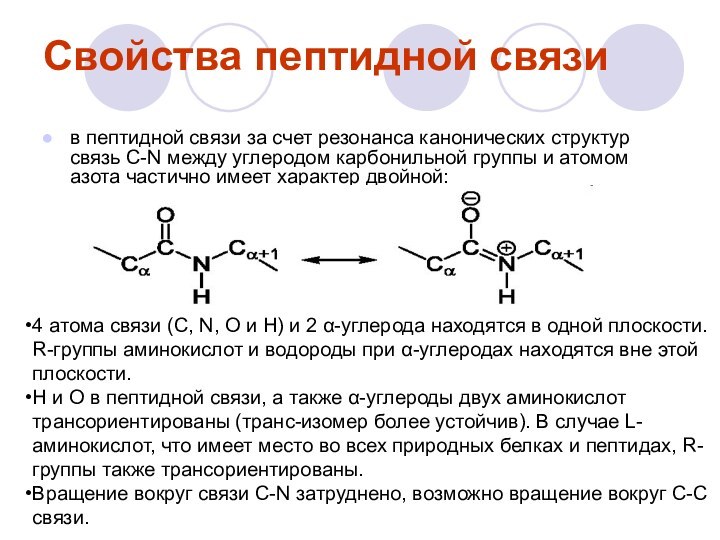
Химические связи в молекуле белка
Пептидная связь - вид
амидной связи, возникающей при образовании белков и пептидов в
результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R