- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Строение электронных оболочек(8 класс)
Содержание
- 2. ВСПОМНИМЧему равно общее количество электронов в атоме?Что
- 3. ЗАПОМНИМЭлектроны, расположенные на последней электронной оболочке, называются
- 4. ТЕМА УРОКА«Строение электронных оболочек атомов химических элементов №1-20»
- 5. Цель урока:научиться составлять электронные формулы атомов элементов
- 6. Электронная оболочкаСовокупность всех электронов в атоме, окружающих
- 7. S – облако
- 8. Алгоритм составления электронных формул.Записываем знак химического элемента
- 9. 1 периодН + 11n=1S1 S1Нe + 22n=1S1
- 10. 2 периодLi + 32 1n=1n=21 S2
- 11. 2 периодС + 62 4n=1n=2N +
- 12. 2 периодF + 92 7n=1n=2Ne +
- 13. 3 периодMg + 122 8 2n=1n=2Al
- 14. 3 периодP + 152 8 5n=1n=2S
- 15. 3 периодAr + 182 8 8n=1n=2K
- 16. Физкультминутка Следим глазами
- 17. Закрепление материалаОпределить число орбиталейhttp://files.school-collection.edu.ru/dlrstore/bb14a031-aae7-11db-abbd-0800200c9a66/ch08_08_04.swfОпределить число электронов на
- 18. Ответьте на вопросыКакие данные об особенностях строения
- 19. Выводы Причина сходства элементов заключается в одинаковом
- 20. Скачать презентацию
- 21. Похожие презентации















Слайд 2
ВСПОМНИМ
Чему равно общее количество электронов в атоме?
Что такое
энергетический уровень?
электронов на внешнем уровне?
Слайд 3
ЗАПОМНИМ
Электроны, расположенные на последней электронной оболочке, называются внешними.
Число
внешних электронов для химических элементов главных подгрупп равно номеру
группы, в которой находится элемент
Слайд 5
Цель урока:
научиться составлять электронные формулы атомов элементов первых
трех периодов ПСХЭ;
объяснять зависимость и закономерные изменения свойств
химических элементов от электронного строения их атомов.
Слайд 6
Электронная оболочка
Совокупность всех электронов в атоме, окружающих ядро
Каждый
электрон имеет свою траекторию движения и запас энергии
Электроны расположены
на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочкиПо мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Слайд 7 S – облако
p- облака
d - облакаОбласть наиболее вероятного местонахождения электрона в пространстве
Форма электронных
облаков (орбиталей)
http://files.school-collection.edu.ru/dlrstore/bb14a035-aae7-11db-abbd-0800200c9a66/ch08_08_08.swf
Слайд 8
Алгоритм составления электронных формул.
Записываем знак химического элемента и
заряд ядра его атома – он равен порядковому номеру
элемента.Определяем количество энергетических уровней (оно равно номеру периода) и количество электронов на каждом уровне.
Составляем электронную формулу, учитывая порядок заполнения каждого уровня – сначала s-электроны, затем – р-электроны: номер уровня, вид орбитали и количество электронов на ней.
http://files.school-collection.edu.ru/dlrstore/bb14a033-aae7-11db-abbd-0800200c9a66/ch08_08_06.swf
Слайд 9
1 период
Н + 1
1
n=1
S
1 S1
Нe + 2
2
n=1
S
1 S2
Одиночный
электрон на незавершенной оболочке
2 спаренных электрона на завершенной оболочке
S
- элементы
Слайд 10
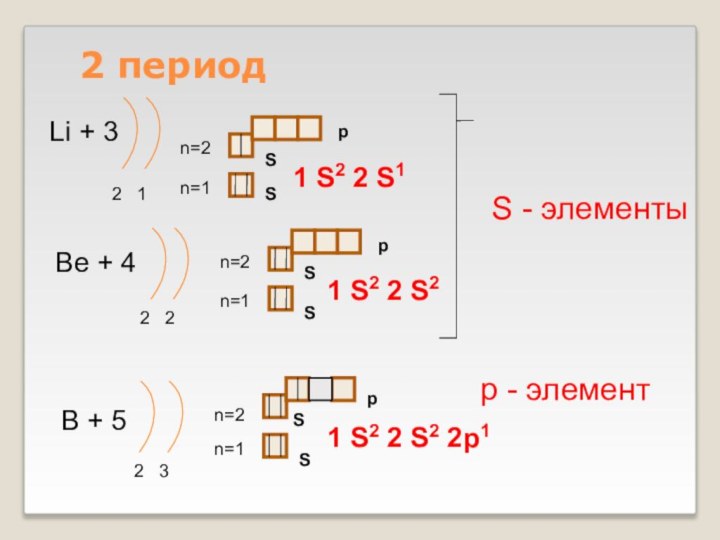
2 период
Li + 3
2 1
n=1
n=2
1 S2 2
S1
Be + 4
2 2
n=1
n=2
1 S2 2 S2
B +
52 3
n=1
n=2
1 S2 2 S2 2p1
S - элементы
р - элемент
S
S
S
S
S
S
p
p
p
Слайд 11
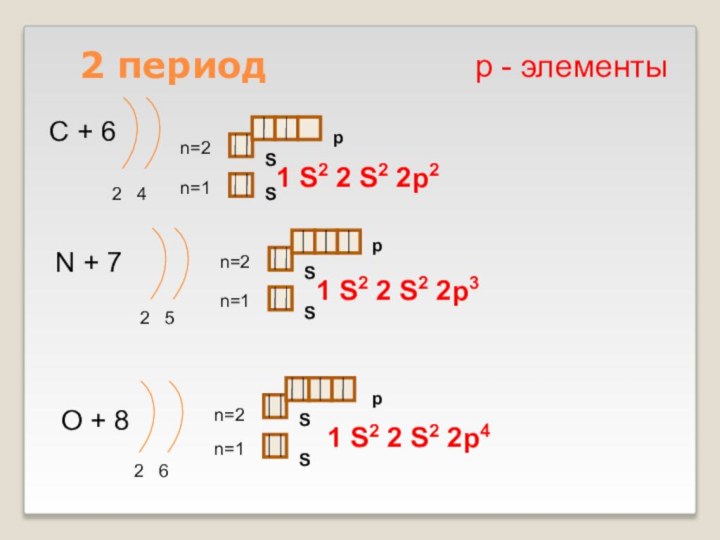
2 период
С + 6
2 4
n=1
n=2
N + 7
2
5
n=1
n=2
O + 8
2 6
n=1
n=2
1 S2 2 S2
2p4р - элементы
1 S2 2 S2 2p2
1 S2 2 S2 2p3
S
S
S
S
S
S
p
p
p
Слайд 12
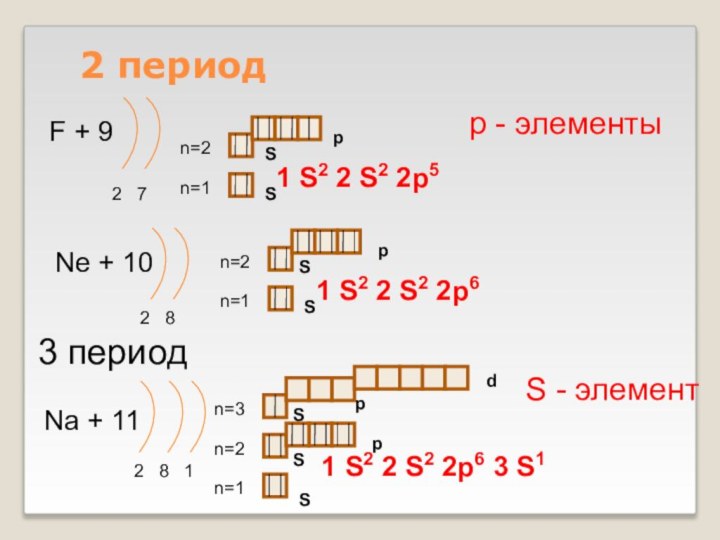
2 период
F + 9
2 7
n=1
n=2
Ne + 10
2
8
n=1
n=2
Na + 11
2 8 1
n=1
n=2
1 S2
2 S2 2p6 3 S1 р - элементы
1 S2 2 S2 2p5
1 S2 2 S2 2p6
3 период
S - элемент
S
S
S
S
S
S
S
p
p
p
p
d
n=3
Слайд 13
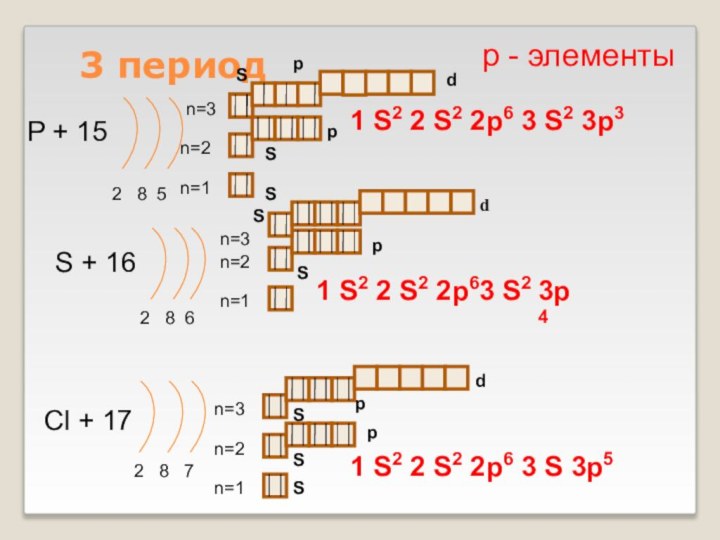
3 период
Mg + 12
2 8 2
n=1
n=2
Al +
13
2 8 3
n=1
n=2
Si + 14
2 8
4n=1
n=2
1 S2 2 S2 2p6 3 S2 3p2
S- р - элементы
1 S2 2 S2 2p6 3 S2
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p1
Слайд 14
3 период
P + 15
2 8 5
n=1
n=2
S +
16
2 8 6
n=1
n=2
Cl + 17
2 8
7n=1
n=2
1 S2 2 S2 2p6 3 S 3p5
р - элементы
1 S2 2 S2 2p6 3 S2 3p3
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p4
d
Слайд 15
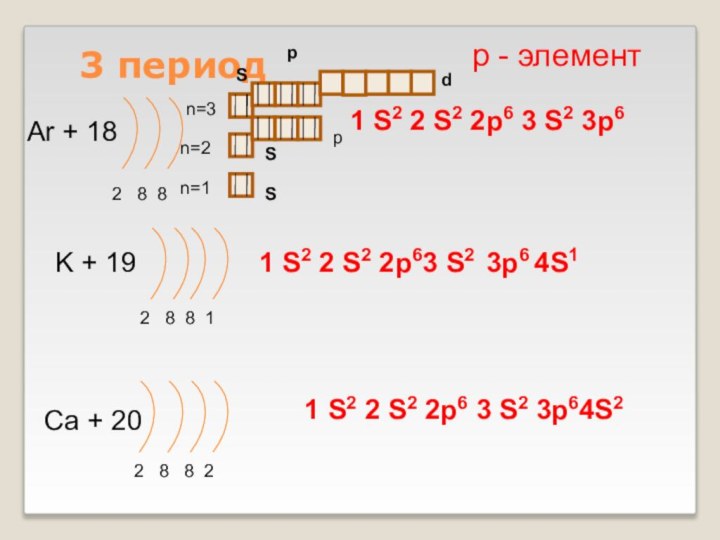
3 период
Ar + 18
2 8 8
n=1
n=2
K +
19
2 8 8 1
Ca + 20
2 8
8 21 S2 2 S2 2p6 3 S2 3p64S2
р - элемент
1 S2 2 S2 2p6 3 S2 3p6
1 S2 2 S2 2p63 S2
S
S
p
n=3
S
p
d
3p6 4S1
Слайд 17
Закрепление материала
Определить число орбиталей
http://files.school-collection.edu.ru/dlrstore/bb14a031-aae7-11db-abbd-0800200c9a66/ch08_08_04.swf
Определить число электронов на внешнем
электронном уровне
http://files.school-collection.edu.ru/dlrstore/bb14a032-aae7-11db-abbd-0800200c9a66/ch08_08_05.swf
Определить общее число электронов на энергетическом уровне
http://files.school-collection.edu.ru/dlrstore/bb14a030-aae7-11db-abbd-0800200c9a66/ch08_08_03.swf
тест «электронные
формулы атомов элементов»http://files.school-collection.edu.ru/dlrstore/bb14a038-aae7-11db-abbd-0800200c9a66/ch08_08_11.swf