- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Аммиак (9 класс)
Содержание
- 2. NH3Эта история произошла во время I мировой войны.
- 3. СтроениеМолекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.Вид химической связи: ковалентная полярная
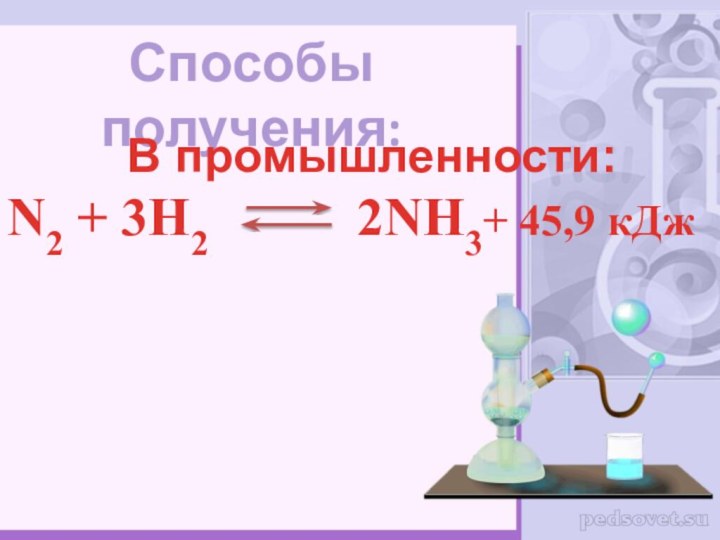
- 4. Способы получения: В
- 5. В лаборатории
- 6. Ц Физические свойстваТкип = -33,50С
- 7. Аммиак реагирует с водой, образуя гидрат
- 8. Три связи образованы по обменному механизмучетвертая
- 9. NH3 + HCl → NH4Cl
- 10. «Дым без огня»
- 11. Горение аммиака в кислороде
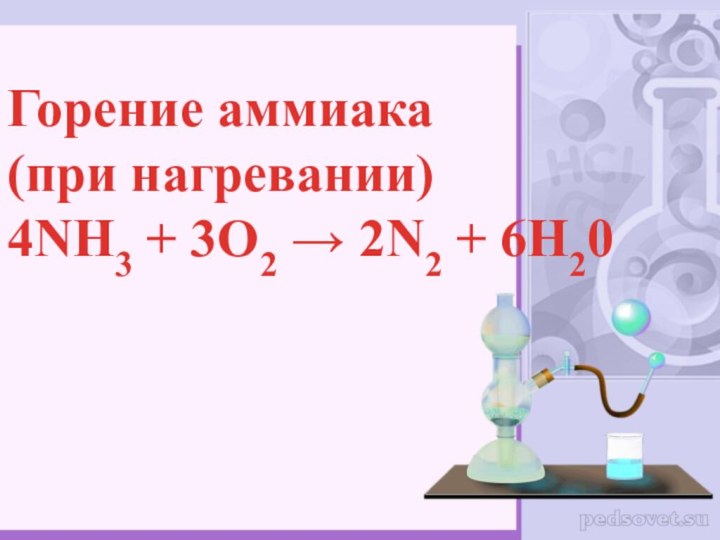
- 12. Горение аммиака(при нагревании)4NH3 + 3O2 → 2N2 + 6H20
- 13. Окисление аммиака в присутствии оксида хрома
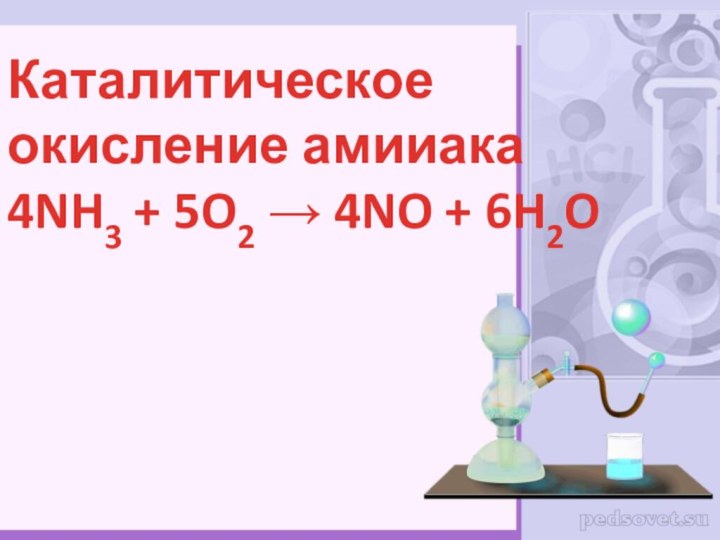
- 14. Каталитическое окисление амииака 4NH3 + 5O2 → 4NO + 6H2O
- 15. ПрименениеNH3Производство азотной кислоты.Производство азотных удобренийПроизводство взрывчатых веществВ холодильных установках.В медицине, в быту.Для паяния
- 16. Проверка знаний. Осуществите цепочку превращений Азот
- 17. Скачать презентацию
- 18. Похожие презентации
NH3Эта история произошла во время I мировой войны.














Слайд 6
Ц
Физические свойства
Ткип = -33,50С
Тпл = -780С
3-10% р-р - нашатырный спирт
18-25% р-р - аммиачная вода
В 1 л Н2О 700 л NH3
легче воздуха
NH3
В
З - резкий
ЯД
Слайд 7 Аммиак реагирует с водой, образуя гидрат аммиака
(аммиачная вода):
NH3 + H2O =NH4OH
Изменяет окраску
индикаторов:Фенолфталеин – б/цв малиновый
Лакмус становится синим
Взаимодействие с водой
Химические свойства
Слайд 8
Три связи образованы по обменному механизму
четвертая –
по донорно-акцепторному.
Донор - молекула или ион, имеющие свободную
пару
электронов.Акцептор - молекула или ион, имеющие
свободную орбиталь.
N
H
H
H
••
H+
N
H
H
H
••
H
+
АКЦЕПТОР
ДОНОР
Образование иона аммония
+
Слайд 9
NH3 + HCl → NH4Cl
хлорид аммония (нашатырь)
2 NH3 + H2SO4 → (NH4)2 SO4
сульфат
аммония
Взаимодействие с кислотами





























