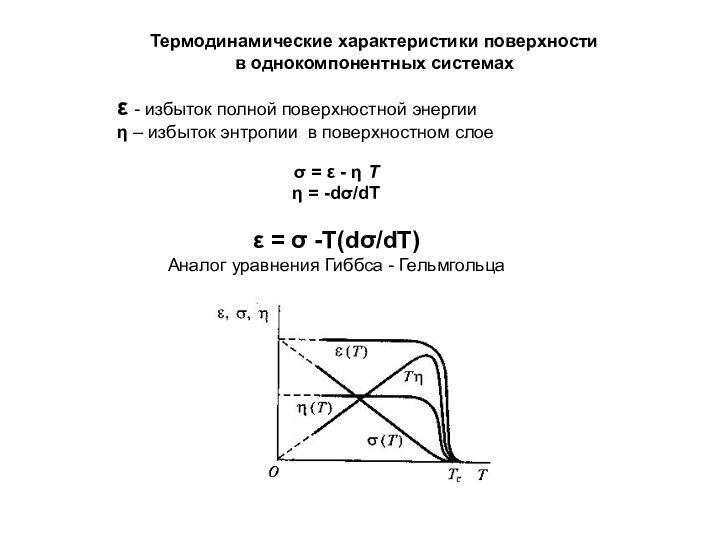
= 2σ
WK ≈ nsZs|u11|
σ = 1/2 WK
≈ 1/2 nsZs|u11| ns ≈ νM -2/3 = (Vm/NA)-2/3
Правило Стефана
νM объем одной молекулы
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть










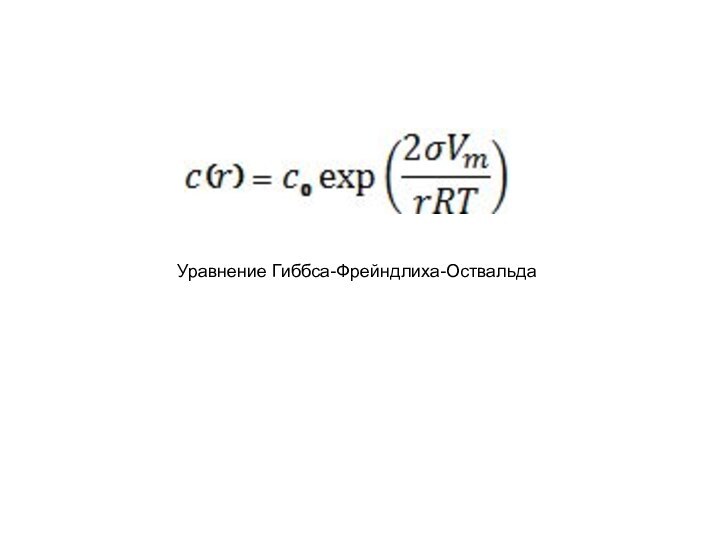
ns ≈ νM -2/3 = (Vm/NA)-2/3
Правило Стефана
νM объем одной молекулы
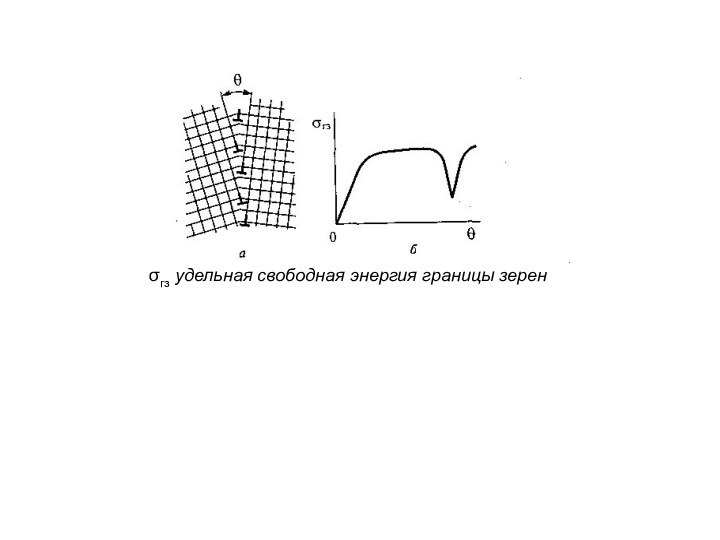
К - средняя плотность избытка энергии Дж/м3
(или недостатка энергии сцепления) в поверхностном слое
U – потенциал Леннарда-Джонса
ориентационное взаимодействие
взаимодействие двух постоянных диполей;
2.индукционное взаимодействие
взаимодействие диполя с неполярной молекулой;
3. дисперсионное взаимодействие
двух неполярных молекул.
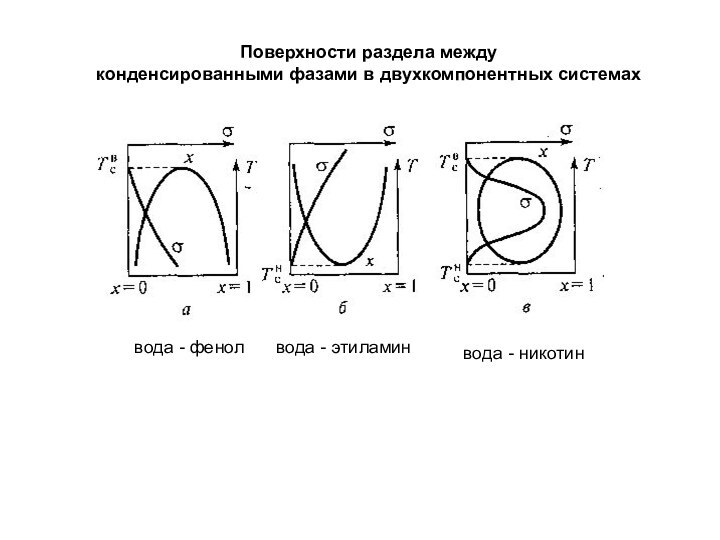
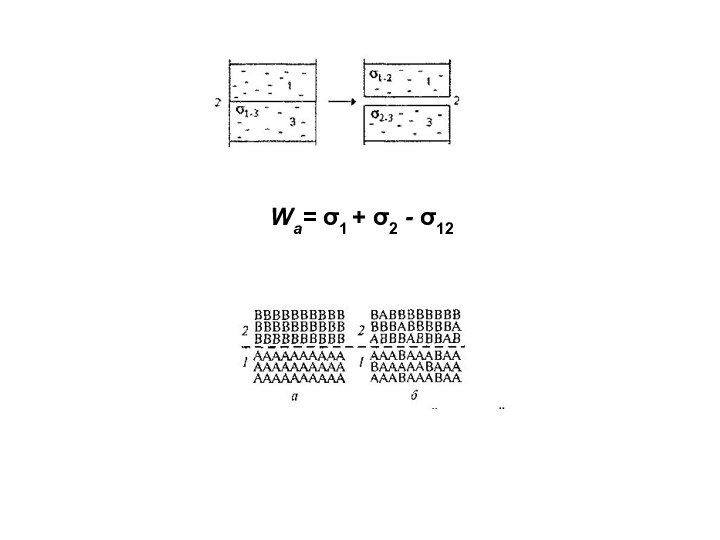
При термодинамическом равновесии
фаз изменение энергии Гиббса: ΔG = 0;
отсюда получаем
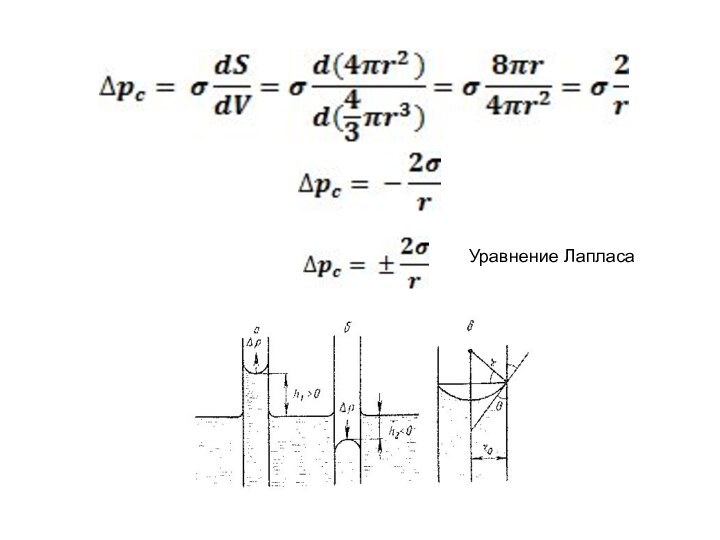
– кривизна поверхности
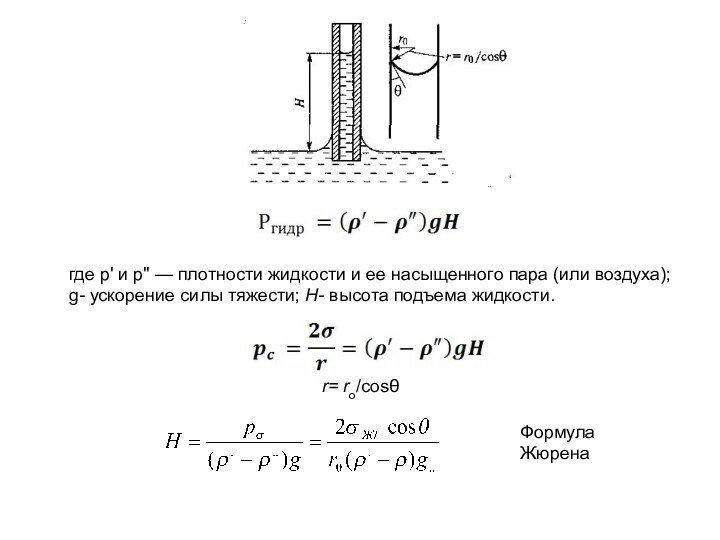
r= ro/cosθ
Формула Жюрена