- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Кислоты в свете ТЭД
Содержание
- 2. “Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”
- 3. Цель урокаДать понятие о кислотах как классе
- 4. Кислота – сложное вещество, состоящее из ионов
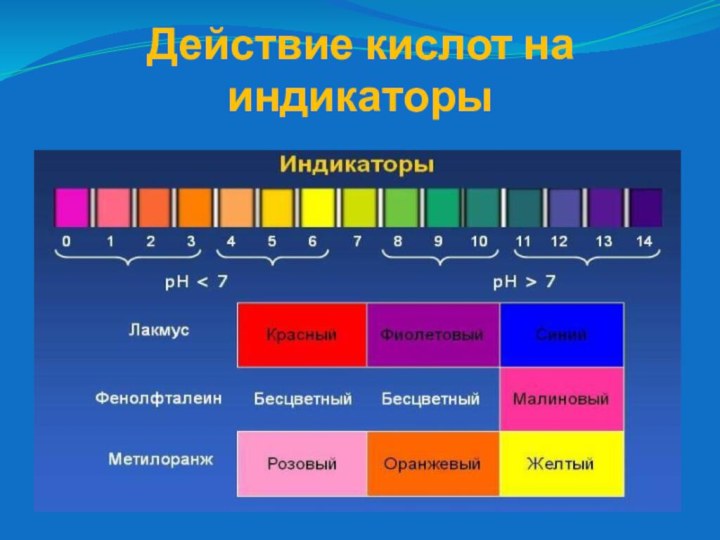
- 5. Химические свойства кислотДействуют на индикаторыВзаимодействуют с металламиВзаимодействуют с оксидами металловВзаимодействуют с основаниямиВзаимодействуют с солями
- 6. Действие кислот на индикаторы
- 7. 1-я лабораторияКислота + основание соль + вода(реакция обмена)
- 8. 2-я лабораторияКислота + оксид металла соль + вода(реакция обмена)
- 9. 3-я лабораторияКислота + металл соль + водород(реакция замещения)
- 10. 4-я лабораторияКислота + соль
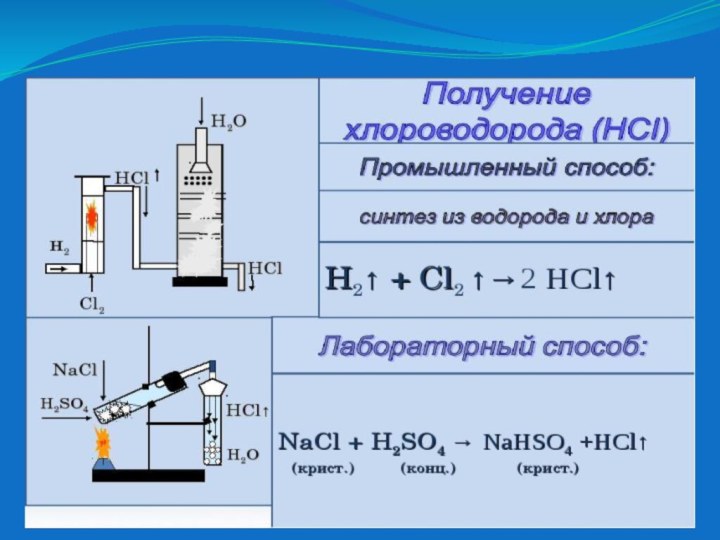
- 11. HClсоляная кислота
- 13. Применение соляной кислоты
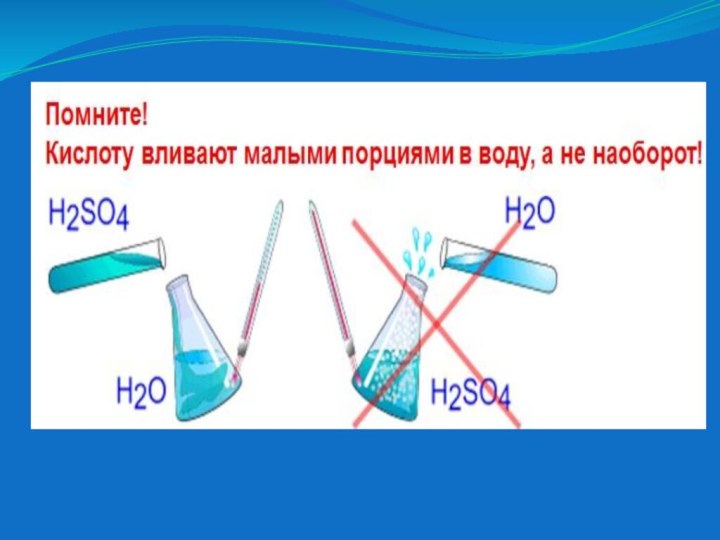
- 14. H2SO4 серная кислота
- 15. Получение серной кислоты1. 2SO2 + O2 = 2SO32. SO3 + H2O = H2SO4
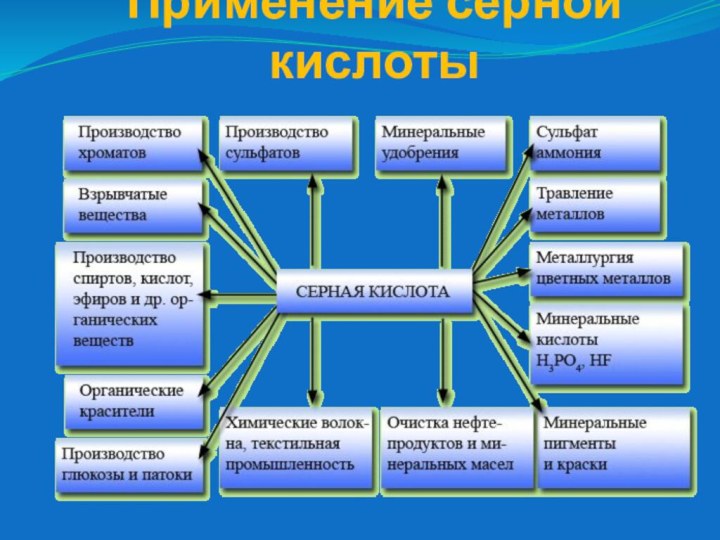
- 17. Применение серной кислоты
- 18. HNO3азотная кислота
- 21. Н2CO3угольная кислота
- 22. Скачать презентацию
- 23. Похожие презентации
“Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”