- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме скорость 11 класс
Содержание
- 2. Скорость химической реакцииХимическая кинетика — раздел физической
- 3. Гомогенные и гетерогенные реакции
- 4. Гомогенные системы: Реакции протекают во
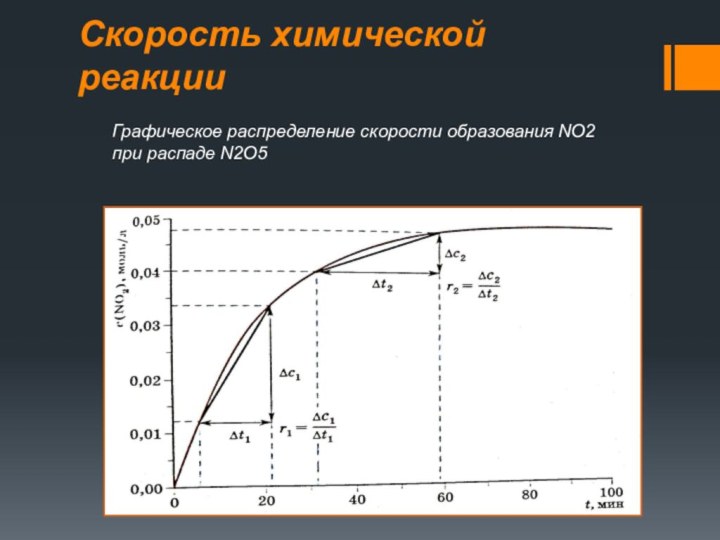
- 5. Скорость химической реакцииГрафическое распределение скорости образования NO2 при распаде N2O5
- 6. Проблема:Как управлять скоростью?Гипотеза: природа реагирующих веществ;ТемператураКонцентрация(давление)Площадь соприкосновениякатализатор?
- 7. ТЕОРИЯ СТОЛКНОВЕНИЙК реакции приводят лишь эффективные столкновения,т.е. такие……………?
- 8. Энергия активацииЭнергия активации — минимальное количество энергии, которое
- 9. Природа реагирующих веществ
- 10. Якоб Вант-Гофф Первая в истории Нобелевская премия по химии – 1901 год
- 11. Температура Правило Вант-Гоффа:
- 12. Правило Вант-ГоффаГде - температурный коэффициент
- 13. Н. И. Бекетов Академик Петербургской АН (1886), один
- 14. Концентрация реагирующих веществ Закон химической кинетики
- 15. Составьте кинетические уравнения для следующих реакцийH2 +
- 16. Поверхность соприкосновения реагирующих веществ Скорость реакции
- 17. Катализаторы и катализКатализаторы – вещества, участвующие в
- 18. Гомогенный и гетерогенный катализ Гомогенный –
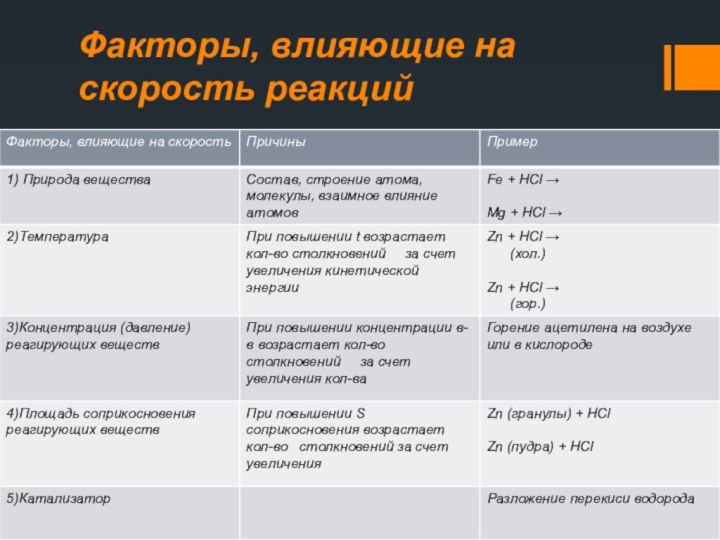
- 19. Факторы, влияющие на скорость реакций
- 20. Задания1. В системе CO + Cl2 ↔
- 21. Скачать презентацию
- 22. Похожие презентации
Скорость химической реакцииХимическая кинетика — раздел физической химии, посвященный скоростям реакций. Скорость — является ключевым понятием химической кинетики.



















Слайд 2
Скорость химической реакции
Химическая кинетика —
раздел физической химии,
посвященный
скоростям
реакций.
Слайд 4 Гомогенные системы: Реакции протекают во всем объёме реакционного
пространства
(газ + газ; ж + ж)
Гетерогенные системы:
На поверхности соприкосновения веществгаз + жидкость;
газ + твердое вещество;
жидкость + твердое вещество.
Слайд 5
Скорость химической реакции
Графическое распределение скорости образования NO2 при
распаде N2O5
Слайд 6
Проблема:
Как управлять скоростью?
Гипотеза: природа реагирующих веществ;
Температура
Концентрация(давление)
Площадь соприкосновения
катализатор?
Слайд 8
Энергия активации
Энергия активации — минимальное количество энергии, которое требуется
сообщить системе (выражается в джоулях на моль), чтобы произошла
реакция.Энергия активации — некоторый энергетический барьер на пути всех частиц
Слайд 9
Природа реагирующих веществ
Скорость химической
реакции зависит от природы реагирующих веществ Под природой
реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах Примеры: Mg + 2HCl = MgCl2 + H2 ↑Zn + 2HCl = ZnCl2 + H2 ↑
Слайд 11
Температура
Правило Вант-Гоффа:
Повышение температуры на каждые 10 °C
Приводит к увеличению
скорости реакции в 2 – 4 раза (эту величину называют
температурным
коэффициентом
реакции).
Слайд 13
Н. И. Бекетов
Академик
Петербургской АН (1886), один из основоположников
физической
химии и химической динамики.
Создатель закона действующих масс
Слайд 14
Концентрация реагирующих веществ
Закон химической кинетики
(закон
действующих масс) : Скорость химической реакции пропорциональна произведению
концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.V = kCaCb
Слайд 15
Составьте кинетические уравнения для следующих реакций
H2 + I2
= 2HI
2Fe + 3Cl2 = 2FeCl3
2NO + O2 =
2NO2C2H4 + H2 = C2H6
Слайд 16
Поверхность соприкосновения реагирующих веществ
Скорость реакции увеличивается
благодаря : - увеличению площади поверхности соприкосновения реагентов (измельчение); - повышению
реакционной способности частиц на поверхности, образующихся при измельчении микрокристаллов - непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идет реакция «кипящий слой в промышленности»нарушением структуры «правильной кристаллической решетки»
Слайд 17
Катализаторы и катализ
Катализаторы – вещества, участвующие в химической
реакции и изменяющие ее скорость или направление, но по
окончании реакции остающиеся неизменными качественно и количественно.Катализ – изменение скорости реакции или ее направления под действием катализаторов.
Слайд 18
Гомогенный и гетерогенный катализ
Гомогенный – катализатор
и реагирующие вещества находятся в одном агрегатном состоянии (фазе).
Окисление оксида серы (IV) в оксид серы (VI) с помощью оксида азота (II).Гетерогенный – катализатор и реагирующие вещества находятся в разных фазах. Разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV).
Слайд 20
Задания
1. В системе CO + Cl2 ↔ COCl2
концентрацию CO увеличили от 0,03 до 0,12 моль/л, а
концентрацию Cl2 — от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?2. Во сколько раз изменится скорость реакции 2А + В → А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
3. Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2 + В2 → 2А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
4. Для увеличения скорости реакции 2CO + O2 = 2CO2 + Q необходимо:
1) увеличить концентрацию СО 3) понизить давление 2) уменьшить концентрацию О2 4) понизить температуру