- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Алюминий
Содержание
- 2. Прослушав легенду, попробуйте отгадать о каком элементе 3-й группы идет речь?
- 3. «Алюминий»
- 4. Изучаемые вопросы: Изучить строение атома алюминияПознакомиться с
- 5. I. История открытия алюминия
- 6. Алюминий 1. Из истории открытияВпервые Al был
- 7. В период открытия алюминия
- 8. II. Что мы знаем об алюминии
- 9. Алюминий Вставьте пропущенноеАлюминий - элемент III
- 10. Алюминий ПроверьтеАлюминий - элемент III
- 11. III. Физические свойства алюминия
- 12. III. Физические свойства алюминия:Агрегатное состояниеЦветБлескПлотностьТвердостьПластичностьПрочностьРастворение в водеТеплопроводностьМагнитные свойстваЭлектропроводностьt плавления и кипения
- 13. II. Физические свойства алюминия:
- 14. IV.Строение Al как простого вещества
- 15. Подумай и ответь:Благодаря чему алюминий обладает такими
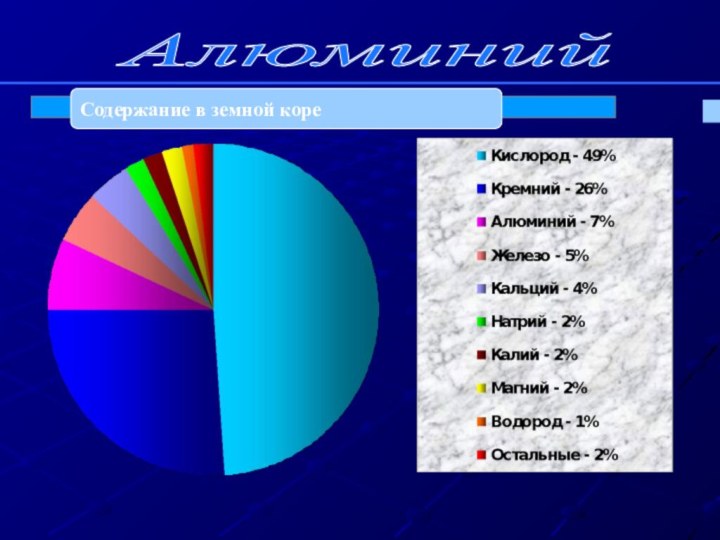
- 16. V.Нахождение Al в природе
- 17. Алюминий Содержание в земной коре
- 18. БОКСИТ
- 19. КОРУНД
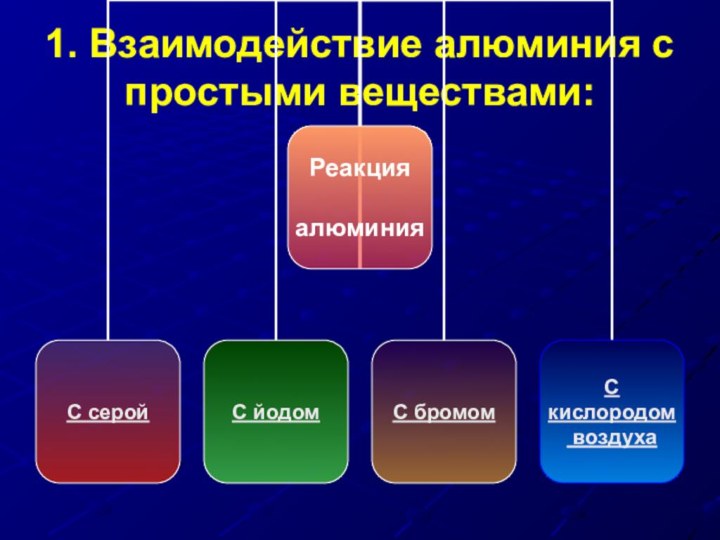
- 20. :VI.Химические свойства алюминия
- 21. Алюминий – активный металл?Al - 3ē ↔ Alвосстановитель+30
- 22. 1. Взаимодействие алюминия с простыми веществами:
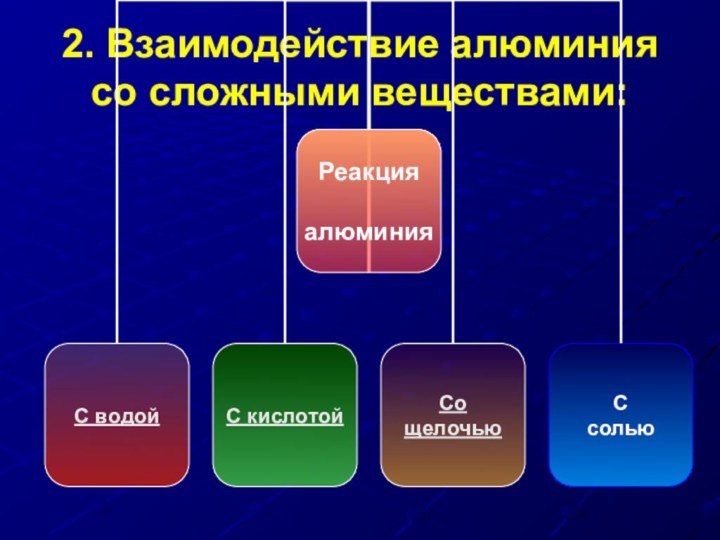
- 23. 2. Взаимодействие алюминия со сложными веществами:
- 24. Активность алюминияВывод: Алюминий - активный металл, реагирует
- 25. 4Al+3O2 = 2Al2O3Al+3Br2 = 2Al Br3Al+3I2 = 2Al I32Al+3S = Al2S3
- 26. 2Al+3CuSO4 =3Cu + Al2(SO4)32Al+2NaOH + 2H2O
- 27. IV. Применение алюминия
- 28. Подведем итоги:Над какой темой мы сегодня работали?Что
- 29. Проверим свои знания !
- 30. Ваши успехи? Подведем итоги!
- 31. Домашнее задание: § 13, стр
- 32. Скачать презентацию
- 33. Похожие презентации
Прослушав легенду, попробуйте отгадать о каком элементе 3-й группы идет речь?



























Слайд 4
Изучаемые вопросы:
Изучить строение атома алюминия
Познакомиться с физическими свойствами
алюминия
Выяснить его химические свойства
Узнать о применении алюминия на основании
его свойств
Слайд 6
Алюминий
1. Из истории открытия
Впервые Al был получен
датским физиком Эрстедом Х.
в 1825 г. Название элемента
происходит от лат.алюмен, так в древности называли квасцы,
которые использовали для крашения
тканей (KAl(SO4)2 . 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
Слайд 7 В период открытия алюминия -
металл был дороже золота. Англичане хотели почтить богатым подарком
великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.Алюминий
1. Из истории открытия
Далее
Слайд 9
Алюминий
Вставьте пропущенное
Алюминий - элемент III
группы, главной подгруппы.
Заряд ядра атома алюминия равен +13.
В ядре
атома алюминия 13 протонов.В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 3е.
На внешнем уровне в атоме 3 электронов.
Степень окисления атома в соединениях равна +3 .
Простое вещество алюминий является металлом.
Оксид и гидроксид алюминия имеют амфотерный характер.
Слайд 10
Алюминий
Проверьте
Алюминий - элемент III группы,
главной подгруппы.
Заряд ядра атома алюминия равен +13.
В ядре атома
алюминия 13 протонов.В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 3е.
На внешнем уровне в атоме 3 электронов.
Степень окисления атома в соединениях равна +3 .
Простое вещество алюминий является металлом.
Оксид и гидроксид алюминия имеют амфотерный характер.
3
главной
13
13
14
13
3
Al +13 2,8,3
3
+3
металлом
амфотерный
Слайд 12
III. Физические свойства алюминия:
Агрегатное состояние
Цвет
Блеск
Плотность
Твердость
Пластичность
Прочность
Растворение в воде
Теплопроводность
Магнитные свойства
Электропроводность
t
плавления и кипения
Слайд 13
II. Физические свойства алюминия:
Алюминий
– металл серебристо- белого цвета, лёгкий ( q= 2,7
г/ см3),t пл. = 6600С, ковок, пластичен, электро- и теплопроводен, легко поддаётся обработке, образует лёгкие и прочные сплавы, магнитных свойств нет.
Слайд 15
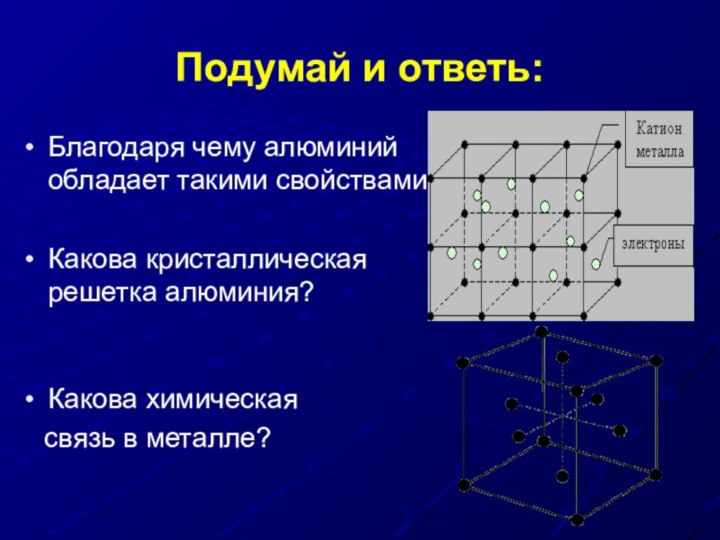
Подумай и ответь:
Благодаря чему алюминий обладает такими свойствами?
Какова кристаллическая решетка алюминия?
Какова химическая
связь в металле?
Слайд 24
Активность алюминия
Вывод: Алюминий - активный металл, реагирует со
многими простыми и сложными веществами.
В реакциях является восстановителемнеметаллов и менее
активных металлов.
Слайд 26
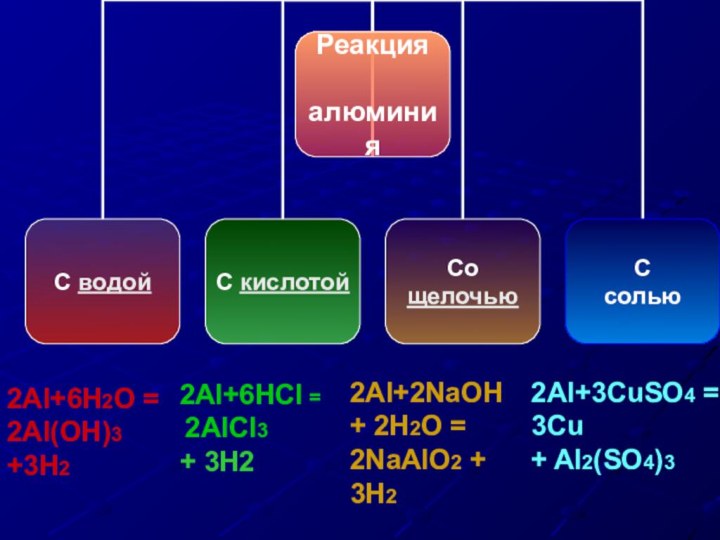
2Al+3CuSO4 =
3Cu
+ Al2(SO4)3
2Al+2NaOH + 2H2O =
2NaAlO2 + 3H2
2Al+6HCl =
2AlCl3
+ 3H2
2Al+6Н2O =
2Al(OH)3 +3H2
Слайд 28
Подведем итоги:
Над какой темой мы сегодня работали?
Что нового
мы узнали об алюминии?
Решили ли мы проблему об активности
алюминия?Какими путями решали эту проблему?
К каким выводам пришли?
Оцените свою работу на уроке!
Слайд 29
Проверим свои знания !
На листке для мини тестов запишите свою фамилию. Выполните
задание на соответствие реагента и продукта реакции.На выполнение теста отводится 5 минут.
Желаю удачи!
Слайд 30
Ваши успехи? Подведем итоги!
Критерии оценки:
«5» - допустима 1 ошибка
«4» - 2 ошибки
«3»
- 3 ошибки«2» - более 3 ошибок