Слайд 2
“Ни одна наука не нуждается в эксперименте в
такой степени как химия. Ее основные законы,
теории и выводы
опираются на факты. Поэтому постоянный контроль опытом необходим”.
Майкл Фарадей
Учебный химический эксперимент – метод обучения, специфика которого состоит в способе познания истины. При самостоятельном выполнении опытов и наблюдениях за ними учащиеся осуществляют качественные изменения веществ. Они познают многообразную природу веществ, накапливают факты для сравнений, обобщений, выводов, убеждаются в возможности управлять сложными химическими процессами.
Слайд 3
Эксперимент – важнейший путь связи теории с
практикой при обучении химии, путь превращения знаний в убеждения.
Химический эксперимент, применяемый в школьной практике, обычно служит подтверждением определенных теоретических положений и занимает подобающее ему ведущее место в обучении химии.
Слайд 4
Без сомненья, все наши знания начинаются с опыта.
Кант
Иммануил
Если учитель хочет, чтобы его предмет вызывал глубокий
интерес у школьников, чтобы ученики умели не только писать химические формулы и уравнения реакций, но и понимали химическую картину мира, умели логически мыслить, чтобы каждый урок был праздником, маленьким представлением, доставляющим радость и ученикам и учителю, то необходимо, чтобы химический эксперимент был на уроках одним из главенствующих.
Слайд 5
Для этого необходимо сделать из ученика активного соучастника
учебного процесса. Ученик может усвоить информацию только в собственной
деятельности при заинтересованности предметом. Поэтому учителю нужно забыть о роли информатора, он должен исполнять роль организатора познавательной деятельности ученика.
Слайд 6
Самостоятельное открытие малейшей крупицы знания учеником доставляет ему
огромное удовольствие, позволяет ощутить свои возможности, возвышает его в
собственных глазах. Ученик самоутверждается как личность. Эту положительную гамму эмоций школьник хранит в памяти, стремится пережить еще и еще раз. Так возникает интерес не просто к предмету, а что более ценно – к самому процессу познания – познавательный интерес.
Слайд 7
Значение химического эксперимента на уроках химии
Развитие познавательных
интересов учащихся в процессе обучения имеет большое значение для
любого учебного предмета. В изучении химии есть свои особенности, которые учителю важно иметь в виду. Прежде всего, это касается использования учебного химического эксперимента, широко применяемого в школе в различных формах. Чтобы успешно преподавать химию, учителю необходимо овладеть школьным химическим экспериментом, в результате которого учащиеся приобретают необходимые знания и умения.
Слайд 8
Школьный химический эксперимент можно разделить на демонстрационный, когда
эксперимент показывает учитель, и ученический, выполняемый учащимися. В свою
очередь ученический эксперимент подразделяют на два вида: лабораторные опыты, проводимые учащимися в процессе приобретения или закрепления новых знаний; практические работы, которые учащиеся проделывают в виде экспериментального решения задач после прохождения конкретной темы.
Слайд 9
При отсутствии химического эксперимента на уроках химии знания
учащихся могут приобрести формальный оттенок – резко падает интерес
к предмету.
Слайд 10
Эксперимент требует от учителя много времени для подготовки
и проведения. Только в таком случае может быть достигнут
ожидаемый педагогический эффект. При этом необходимо учитывать и свой опыт работы, и опыт других педагогов, известный по литературе и личному общению. Если учитель свободно владеет химическим экспериментом и применяет его для приобретения новых знаний и умений, то учащиеся с интересом изучают химию. Они глубоко вникают в сущность проводимых опытов, задумываются над их результатами и пытаются ответить на вопросы только в том случае, если эксперимент поражает воображение и сильно влияет на эмоциональную сферу
Слайд 11
Но для того, чтобы эксперимент не приобрел развлекательный
характер, учащимся с самого начала должна быть ясна цель
проводимых опытов. Эксперимент дает возможность не только устанавливать новые факты, исправлять ошибки в знаниях учащихся, а также позволяет формировать научную картину мировоззрения школьников.
Слайд 12
Экспериментальный тур школьной олимпиады
по химии в 8
классе
Задание 1. Вам выдали в четырех пронумерованных пробирках воду
и растворы следующих веществ: H2SO4,
HCL, Ba(OH)2. Определите содержимое пробирок,
пользуясь этими веществами и выданными вам индикаторами (метиловый оранжевый и фенолфталеин). Составьте уравнения проведенных реакций.
Слайд 14
Качественная реакция на сульфат-ион
Ba(OH)2 + H2SO4 =
BaSO4 + 2H2O
Белый молочный
осадок
Слайд 15
Задание 2. Смесь веществ состоит из меди, железа,
серы и
сахара. На основании схемы разделения веществ укажите,
какое из буквенных обозначений в схеме соответствует каждому веществу и какой метод позволит выделить вещество D из раствора?
Осуществите разделение на практике
Слайд 16
Вещество А – это железо, обладает магнитными свойствами,
поэтому его можно отделит с помощью магнита.
Вещество В –
сера, т.к. она легкая, то её можно отделить флотацией (добавить воды, дать отстояться и собрать с поверхности).
Вещество С – медь, при фильтровании остается на фильтре.
Вещество D - сахар, растворенный в воде. Получить чистые кристаллы сахара можно выпариванием.
Слайд 17
Экспериментальный тур школьной олимпиады
по химии в 9
классе
Задание 1 .В пяти пронумерованных пробирках находятся вода и
растворы серной кислоты, уксусной кислоты, нашатыр-ного спирта (раствора аммиака в воде), фиолетового лакмуса. Как распознать эти вещества, не пользуясь дополнительными реактивами? Проведите экспериментальное определение содержимого пробирок. Составьте уравнения проведенных реакций.
фиолетовый цвет (нейтральная среда)
H2SO4 + лакмус
красный цвет
Уксусная кислота – резкий запах уксуса
NH4OH + лакмус синий цвет, имеет резкий запах аммиака
Слайд 19
Задание 2. Вам выдан галогенид состава ВаГ2 .
Предложите методы качественного определения состава этой соли.
Экспериментально установите её состав и запишите уравнения проведенных реакций.
Качественная реакция на ионы бария:
BaСl2 + H2SO4 = BaSO4 + 2HCl
Белый молочный
осадок
Качественная реакция на ионы хлора:
ВаCl2 + 2AgNO3 = 2AgCl + Ba(NO3)2
Белый хлопьевидный
осадок
Слайд 20
Нагрев медную проволоку, опустить её в раствор хлорида
бария, а затем быстро внести в верхнюю часть пламени.
Присутствие ионов бария можно узнать по окрашиванию пламени в желто-зеленый цвет.
Определение ионов Ba2+
Слайд 21
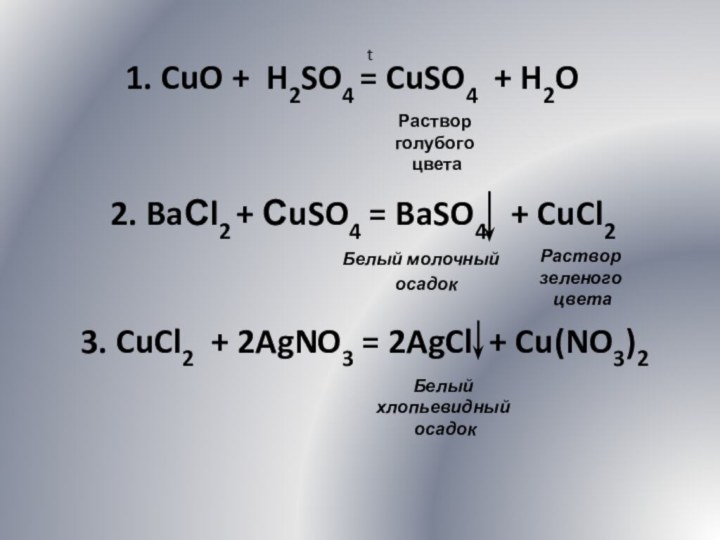
Задание 3. Напишите уравнения реакций, с помощью которых
можно осуществить следующие превращения:
CuO CuSO4
CuCl2 Cu(NO3)2 Cu(OH)2 CuO
Экспериментально осуществите указанные химические превращения. Запишите наблюдаемые явления.
Слайд 22
1. CuO + H2SO4 = CuSO4 + H2O
t
Раствор
голубого
цвета
2. BaСl2 + СuSO4 = BaSO4 +
CuCl2
Белый молочный
осадок
Раствор зеленого
цвета
3. CuCl2 + 2AgNO3 = 2AgCl + Cu(NO3)2
Белый хлопьевидный
осадок
Слайд 23
4. Cu(NO3)2 + 2NaOH = Cu(OH)2
+ 2NaNO3
Голубой осадок
5. Cu(OH)2
CuO+ H2O
t
Голубой цвет
Черный цвет