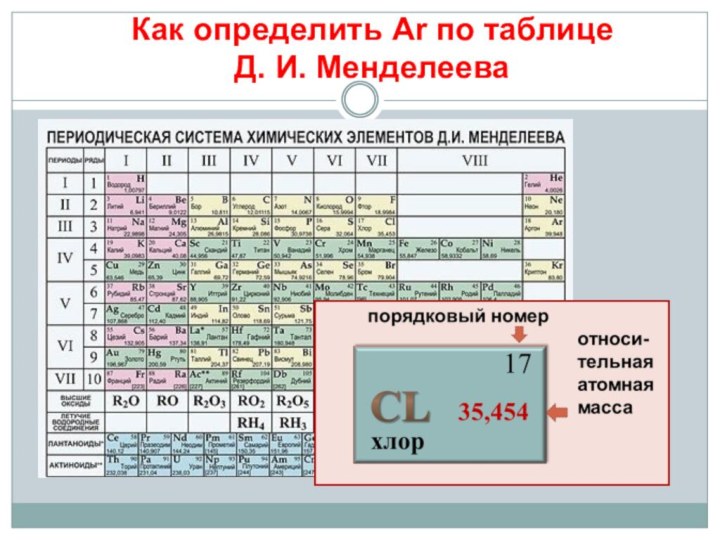
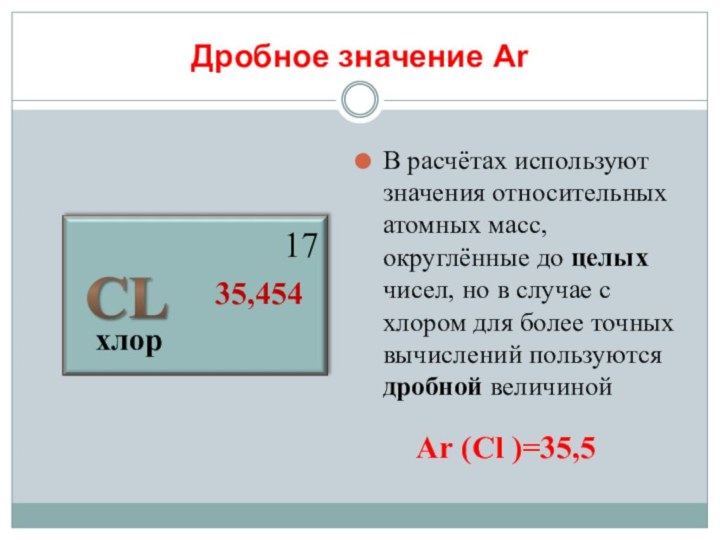
Дальтон (1766-1844)
английский физик и
химик , изучая газы в составе воздуха , сделал вывод:«Я считаю, что атомы одного элемента одинаковы между собой, но отличаются от атомов других элементов. Если об их размерах нельзя сказать ничего определённого, то об основном их физическом свойстве говорить можно: атомы имеют вес».