Слайд 2
Проверка темы: «s-Элементы» (10 минут)
4Mg + 5H2SO4
(конц.) = 4MgSO4 + H2S + 4H2O
MgSO4 +
2NaOH = Mg(OH)2↓ + Na2SO4
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Слайд 3
Проверка темы: «s-Элементы» (10 минут)
4Ba + 10HNO3
(оч. разб.) = 4Ba(NO3)2 + NH4NO3 + 3H2O
Ba(NO3)2
= Ba(NO2)2 + O2
2Ba(NO2)2 = 2BaO + 4NO (или N2) + O2
BaO + H2O = Ba(OH)2
Слайд 4
Комплексообразование
Учитель химии, п.д.о. Воронаев И.Г.
Слайд 5
Комплексы – сложные вещества, содержащие центральный атом, связанный
с несколькими молекулами или ионами (лигандами).
Самый многочисленный класс
неорганических соединений!
Слайд 6
K3[Fe(CN)6]
Внешняя сфера
(внешнесферный катион)
Центральный атом
(комплексообразователь)
Лиганды
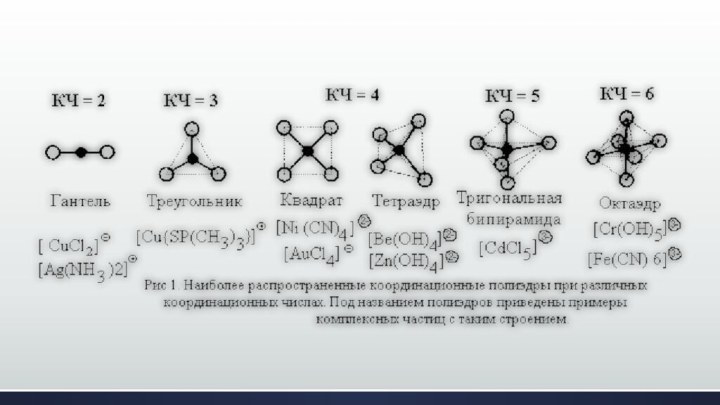
Координационное число
Слайд 10
K3[Fe(CN)6]
Гексацианоферрат (III) калия
(красная кровяная соль)
Слайд 11
Важные замечания:
Исчерпывающего определения комплекса дать нельзя!
Чаще всего в
роли комплексообразователя (центрального атома) выступает электроположительная частица (электрофил, акцептор
электронов), способная связывать донорные молекулы или ионы.
Наиболее типичные комплексообразователи – ионы d- и f- металлов, Al, Be.
Слайд 13
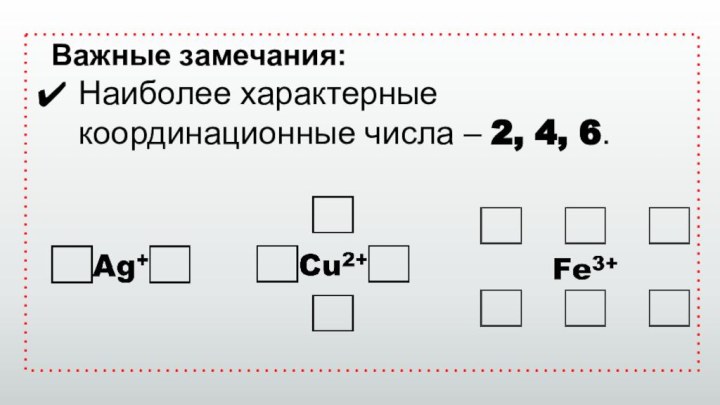
Важные замечания:
Наиболее характерные координационные числа – 2, 4,
Слайд 15
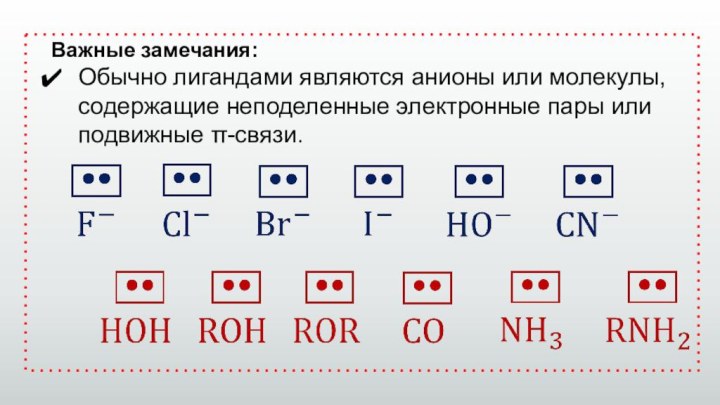
Важные замечания:
Обычно лигандами являются анионы или молекулы, содержащие
неподеленные электронные пары или подвижные π-связи.
Слайд 16
Важные замечания:
Один и тот же лиганд может образовывать
несколько связей, т.е. быдь полидентатным
молекула этилендиамина
анион щавелевой кислоты
анион глицина
Слайд 17
Важные замечания:
Связи во внутренней сфере комплекса ковалентные! Исходя
из суммарного заряда внутренней сферы комплексы подразделяются на:
катионные
[Cu(NH3)4]2+
анионные
[Fe(CN)6]3-
нейтральные
[Fe(CO)5]0
Слайд 18
катионные
[Cu(NH3)4]2+
анионные
[Fe(CN)6]3-
нейтральные
[Fe(CO)5]
[Pt(NH3)2Cl2]
[Cu(NH3)4]Cl2
[Cu(NH3)4]SO4
[Cu(NH3)4](NO3)2
K3[Fe(CN)6]
Ca3([Fe(CN)6])2
Al[Fe(CN)6]
Слайд 19
Важные замечания:
Разные лиганды по-разному связываются с комплексообразователем: одни
прочно, другие нет – этот факт объясняется поляризуемостью, и
называется ЖМКО.
Чем меньше радиус и число электронов у частицы, тем менее она поляризуема, тем она ЖЕСТЧЕ, и наоборот…
Слайд 20
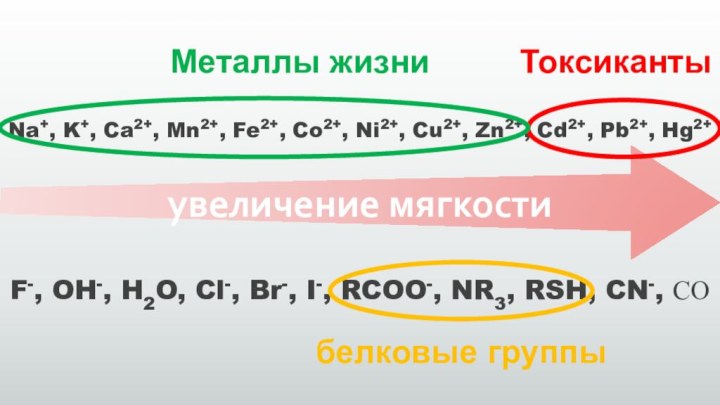
Na+, K+, Ca2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+,
Zn2+, Cd2+, Pb2+, Hg2+
F-, OH-, H2O, Cl-, Br-, I-,
RCOO-, NR3, RSH, CN-, СО
увеличение мягкости
Слайд 21
Na+, K+, Ca2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+,
Zn2+, Cd2+, Pb2+, Hg2+
F-, OH-, H2O, Cl-, Br-, I-,
RCOO-, NR3, RSH, CN-, СО
увеличение мягкости
Токсиканты
Металлы жизни
белковые группы
Слайд 22
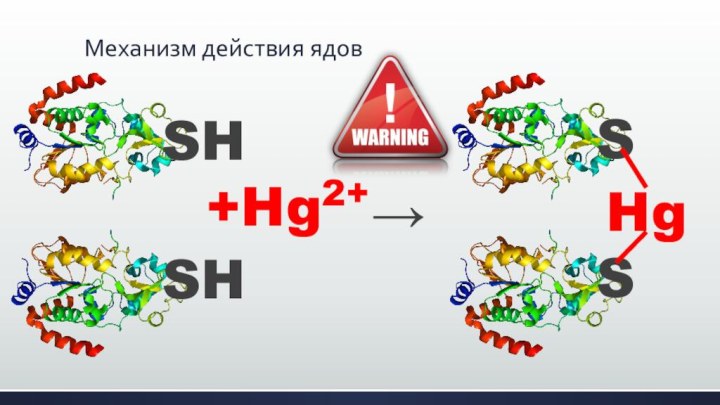
Механизм действия ядов
SH
SH
+Hg2+
→
Hg
S
S
Слайд 23
Каким ядом был отравлен Джоффри Баратеон, если его
венозная кровь, оттекающая от тканей и органов, приобрела алый,
артериальный цвет?
Слайд 24
Ответ: цианидами.
Проникая в кровеносное русло, цианиды очень скоро
оказываются в клеточных структурах, прежде всего в митохондриях, где
протекают ферментативные процессы тканевого окисления (потребления клетками кислорода).
Слайд 27
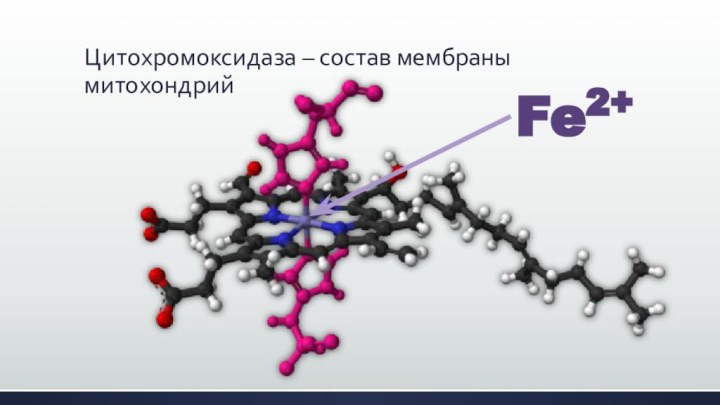
Цитохромоксидаза – состав мембраны митохондрий
Fe2+
Слайд 28
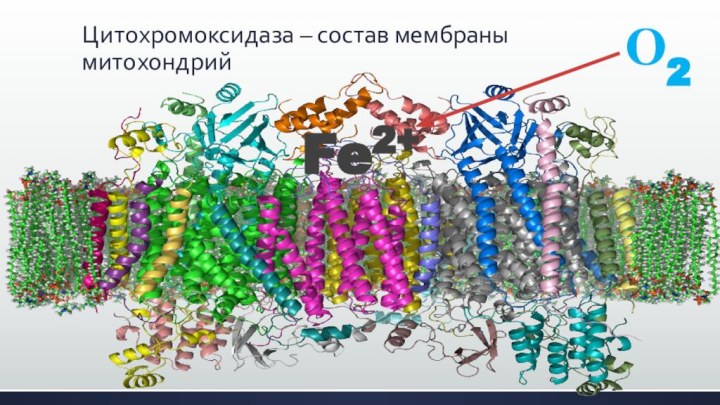
Цитохромоксидаза – состав мембраны митохондрий
Fe2+
О2
Слайд 29
Цитохромоксидаза – состав мембраны митохондрий
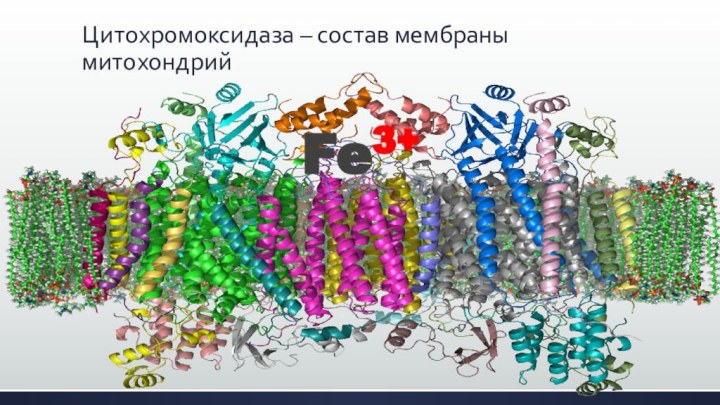
Fe3+
Слайд 30
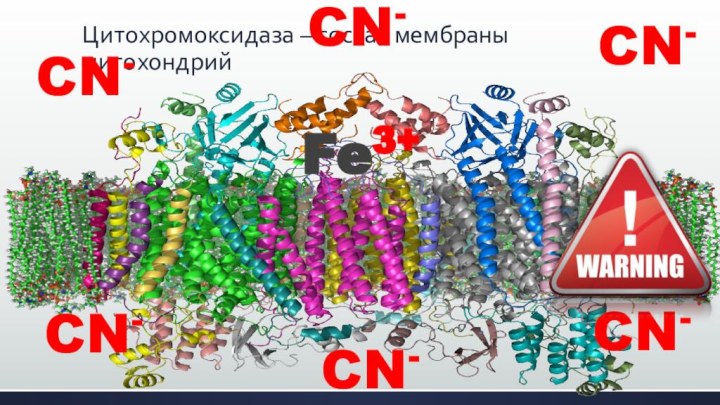
Цитохромоксидаза – состав мембраны митохондрий
Fe3+
CN-
CN-
CN-
CN-
CN-
CN-
Слайд 32
Как называть?
1) В названии КС первым указывают
анион, затем катион.
2) Название комплексной части начинают с указания
состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
Слайд 33
Как называть?
4) Затем называют комплексообразователь, используя корень
его латинского названия и окончание -ат, после чего римскими
цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Слайд 34
Примеры:
K3[Fe(CN)6]
гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2]
дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3]
трифторотриаквахром
Слайд 35
Примеры:
[Сo(NH3)3Cl(NO2)2]
динитритохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2
хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3
нитрат тетрааквалития
Слайд 36
K4[Fe(CN)6] НАЗВАНИЯ КОМПЛЕКСОВ ПО РАЗЛИЧНЫМ НОМЕНКЛАТУРАМ 4[ (
)6] тривиальное – желтая кровяная соль, два полусистематических –
железосинеродистый калий, ферроцианид калия два систематических по IUPAC – тетракалийгексацианоферрат(II), гексацианоферрат(II) (тетра)калия, а также «гибридное» – гексацианоферроат калия. K3[Co(NO2)6] тривиальное – соль Фишера, полусистематическое – кобальтинитрит калия, четыре систематических по IUPAC – трикалийгексанитритокобальтат(III), гексанитритокобальтат(III) (три)калия, трикалийгекса[триоксонитрат(III)] кобальтат(III), гекса[триоксонитрат(III)]кобальтат(III) трикалия, «гибридное» - гексанитритокобальтиат калия. [Pt(NH3)5Cl]Cl3 ( 3)5 тривиальное – соль Чугаева, полусистематическое – хлорид пентамминхлороплатины, два систематических систематических по IUPAC – (три)хлорид пентамминохлороплатины пентамминохлороплатины(IV), пентамминхлороплатина(IV)(три)хлорид, «гибридное» - пентамминхлороплатехлорид.
Слайд 37
Примеры комплексных соединений различных цветов
Слайд 39
Минералы
Берилл Al2[Be3(Si6O18)]
Аквамарин
Изумруд
Гелиодор





![Презентация по химии на тему Комплексообразование K3[Fe(CN)6]Внешняя сфера(внешнесферный катион)Центральный атом(комплексообразователь)ЛигандыКоординационное число](/img/tmb/7/661262/1d3e29ed9a0f57aa39b9ba192234a0da-720x.jpg)
![Презентация по химии на тему Комплексообразование K3[Fe(CN)6]](/img/tmb/7/661262/bbafb1e620804337ac7c3a7b841736bf-720x.jpg)
![Презентация по химии на тему Комплексообразование K3[Fe(CN)6]](/img/tmb/7/661262/fea45df2359eb5e0b7d2e6c39d9d1647-720x.jpg)
![Презентация по химии на тему Комплексообразование K3[Fe(CN)6]](/img/tmb/7/661262/debb54c4f00f66f8fce7cefe155d0c54-720x.jpg)
![Презентация по химии на тему Комплексообразование K3[Fe(CN)6]Гексацианоферрат (III) калия(красная кровяная соль)](/img/tmb/7/661262/49699d41df5efe7f771a37dcd1afe53e-720x.jpg)



![Презентация по химии на тему Комплексообразование Важные замечания:Связи во внутренней сфере комплекса ковалентные! Исходя из суммарного заряда внутренней сферы комплексы подразделяются на:катионные[Cu(NH3)4]2+анионные[Fe(CN)6]3-нейтральные[Fe(CO)5]0](/img/tmb/7/661262/51998260c41d520d4658b3a691ae6d1f-720x.jpg)
![Презентация по химии на тему Комплексообразование катионные[Cu(NH3)4]2+анионные[Fe(CN)6]3-нейтральные[Fe(CO)5][Pt(NH3)2Cl2][Cu(NH3)4]Cl2[Cu(NH3)4]SO4[Cu(NH3)4](NO3)2K3[Fe(CN)6]Ca3([Fe(CN)6])2Al[Fe(CN)6]](/img/tmb/7/661262/e54535fe298fa68920403b61468789c7-720x.jpg)





![Презентация по химии на тему Комплексообразование [Fe(CN)6]3-](/img/tmb/7/661262/4b10ce1d8575536f99457baa99ba54fd-720x.jpg)


![Презентация по химии на тему Комплексообразование Примеры:K3[Fe(CN)6] гексацианоферрат(III) калия(NH4)2[PtCl4(OH)2] дигидроксотетрахлороплатинат(IV) аммония[Сr(H2O)3F3] трифторотриаквахром](/img/tmb/7/661262/ddd717708ab3dde377b778b976c91c38-720x.jpg)
![Презентация по химии на тему Комплексообразование Примеры:[Сo(NH3)3Cl(NO2)2] динитритохлоротриамминкобальт[Pt(NH3)4Cl2]Cl2 хлорид дихлоротетраамминплатины(IV)[Li(H2O)4]NO3 нитрат тетрааквалития](/img/tmb/7/661262/b068b568d1b2640070de1dfd3376ec88-720x.jpg)
![Презентация по химии на тему Комплексообразование K4[Fe(CN)6] НАЗВАНИЯ КОМПЛЕКСОВ ПО РАЗЛИЧНЫМ НОМЕНКЛАТУРАМ 4[ ( )6] тривиальное – желтая](/img/tmb/7/661262/07d0509ba73ac3c2faab2439690b736e-720x.jpg)


![Презентация по химии на тему Комплексообразование МинералыБерилл Al2[Be3(Si6O18)]АквамаринИзумрудГелиодор](/img/tmb/7/661262/552e8a342afd74d3a3903ea52c8a7a09-720x.jpg)
