- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Светоносный элемент
Содержание
- 2. Содержание Стр.
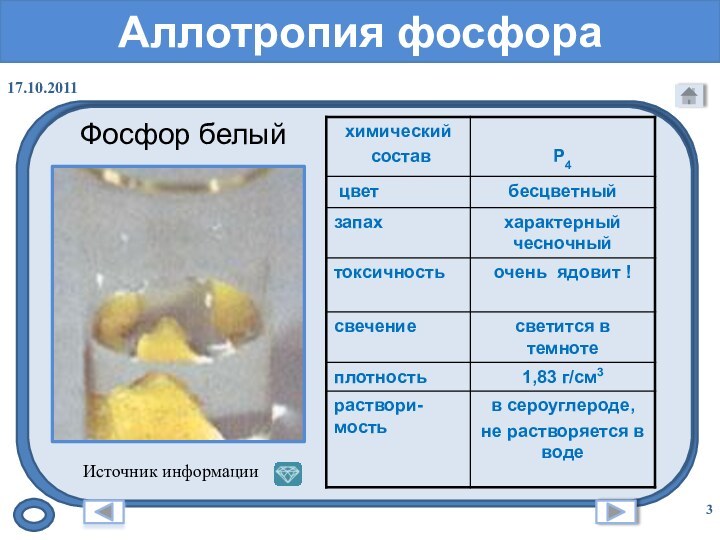
- 3. Аллотропия фосфораФосфор белый Источник информации
- 4. Аллотропия фосфораФосфор красный Источник информации : не имеет
- 5. Аллотропное превращение красного фосфора Источник
- 6. Природные соединения фосфораАпатит Источник информации : Описание минерала
- 7. Природные соединения фосфораВивианит Источник информации : Описание минералаFe3(PO4)2·8H2OБесцветный, зелёный, голубой, тёмно-зелёный, голубовато-зелёный
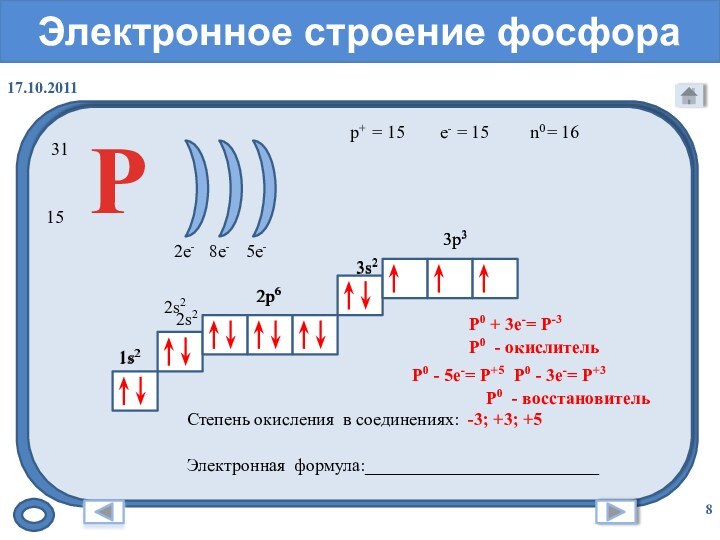
- 8. Электронное строение фосфора= 15 3115= 16p+n0e-= 15Р
- 9. Химические свойства фосфораВзаимодействие с металлами: 3Mg
- 10. Химические свойства оксида фосфора (V)
- 11. Химические свойства фосфорной кислоты Взаимодействие
- 12. Метод электронного балансаРасстановка коэффициентов методом электронного баланса
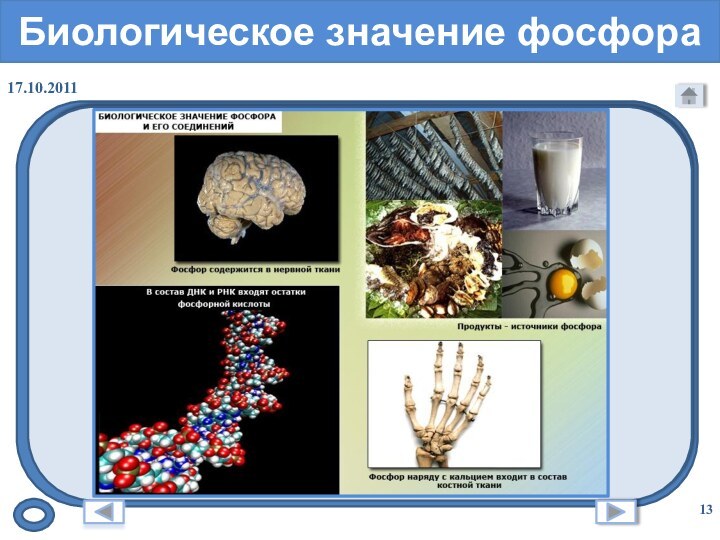
- 13. Биологическое значение фосфора
- 14. Скачать презентацию
- 15. Похожие презентации










Слайд 7
Природные соединения фосфора
Вивианит
Источник информации
:
Описание минерала
Fe3(PO4)2·8H2O
Бесцветный, зелёный, голубой, тёмно-зелёный, голубовато-зелёный
Слайд 8
Электронное строение фосфора
= 15
31
15
= 16
p+
n0
e-
= 15
Р
2e-
8e- 5e-
1s2
2s2
3s2
2p6
3p3
Степень окисления в соединениях:
Электронная формула:__________________________
Р0 + 3е-= Р-3
Р0 - окислитель
1s2
2s2
2p6
3s2
3p3
-3; +3; +5
Р0 - 5е-= Р+5
Р0 - восстановитель
Р0 - 3е-= Р+3
Слайд 9
Химические свойства фосфора
Взаимодействие с металлами:
3Mg +
2P = 2 Mg3P2
3Сa + 2P
= 2 Ca3P2Взаимодействие с неметаллами:
4Р + 5O2 = 2P2O5
2Р + 3Cl2 = 2PCl3
Источник фото:
Фото. Горение фосфора
Фосфор может проявлять как окислительные, так и восстановительные свойства
Вывод
Слайд 10
Химические свойства оксида фосфора (V)
Взаимодействие с водой:
P2O5 + H2O H3PO4Взаимодействие с кислотой:
P2O5 + KOH K3 PO4 + H2O
P2O5 +6OH - = 2 PO4 3- + 3H2O
Взаимодействие с основным оксидом :
3СаO + P2O5 = Сa3(PO4)2
P2O5 - кислотный оксид
Сокращённое ионное уравнение
Вывод
Слайд 11
Химические свойства фосфорной кислоты
Взаимодействие с
металлами:
Mg + H3PO4
Mg3 (PO4)2 + H2Взаимодействие с основаниями:
H3PO4 + KOH K3 PO4 + H2O
H+ + OH - = H2O
Взаимодействие с основным оксидом :
СаO + H3PO4 Сa3(PO4)2 + H2O
Взаимодействие с растворами солей:
AgNO3 + H3PO4 Ag3PO4 + HNO3
Ag++ PO43- Ag3PO4
Сокращённое ионное уравнение
Сокращённое ионное уравнение
Ag3PO4
Слайд 12
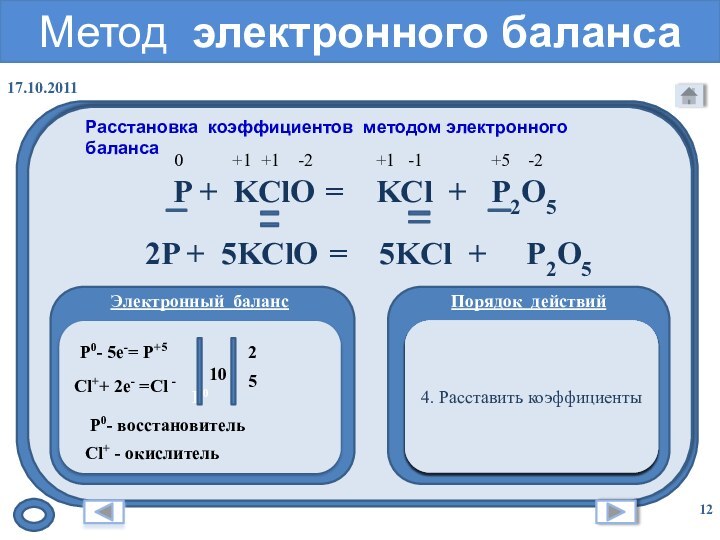
Метод электронного баланса
Расстановка коэффициентов методом электронного баланса
Электронный
баланс
Порядок действий
1. Расставить степени окисления химических элементов
P +
KClO = KCl + P2O5 P0
0 +1 +1 -2 +1 -1 +5 -2
2. Подчеркнуть элементы, изменившие степень окисления
3. Составить полуреакции окисления и восстановления
P0- 5e-= P+5
Cl++ 2e- =Cl -
10
5
2
P0- восстановитель
Cl+ - окислитель
4. Расставить коэффициенты
2P + 5KClO = 5KCl + P2O5