Слайд 2
Введение
Данный курс рассчитан на
ускоренную подготовку к ЕГЭ.
Рассматриваются только те
вопросы ,которые входят в экзаменационные задания.
Обращается внимание на ключевые понятия.
Теория подкрепляется заданиями для самостоятельной работы.
Закрепление идет по тестовым заданиям взятых из ЕГЭ.
Слайд 3
Химическая формула
Вещества состоят из атомов .Они различные.
Атомы отличаются
по строению и свойствам. Химический элемент-это определенный вид атома,
например: атом железа-Fe , атом серы-S, атом меди-Cu и т.д
Атомы образуют молекулы. Молекулы могут быть простых веществ (Н2,О2) и сложных(Н2СО3).
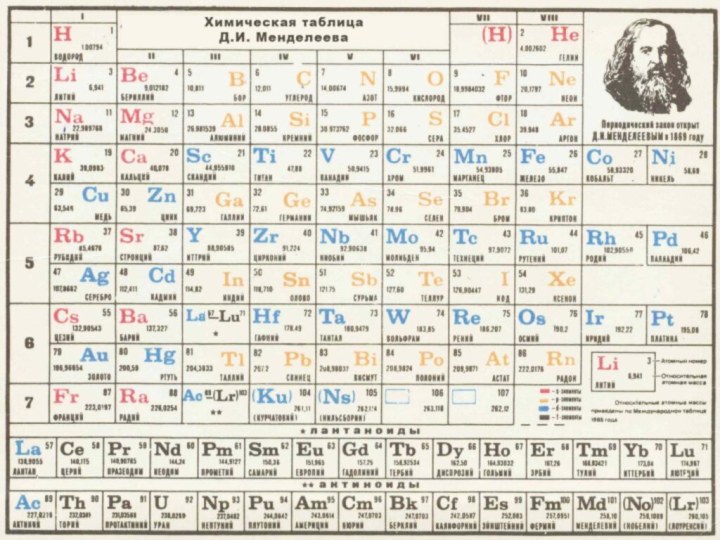
Атомы имеют относительную атомную массу, ее можно найти в периодической таблице . Например: элемент №15 –фосфор. Ач(Р)=31а.е.м, элемент №20 кальций Ач(Са)=40а.е.м
Химическая формула показывает число атомов объединенных в одной молекуле
4 H2SO4
коэффициент индексы
(число молекул) (число атомов)
Характеристика молекулы вещества по составу:
1 молекула состоит из:2 атомов водорода, 1 атома серы , 4 атомов кислорода.
В 4 молекулах:8 атомов водорода, 4атома серы, 16 атомов кислорода
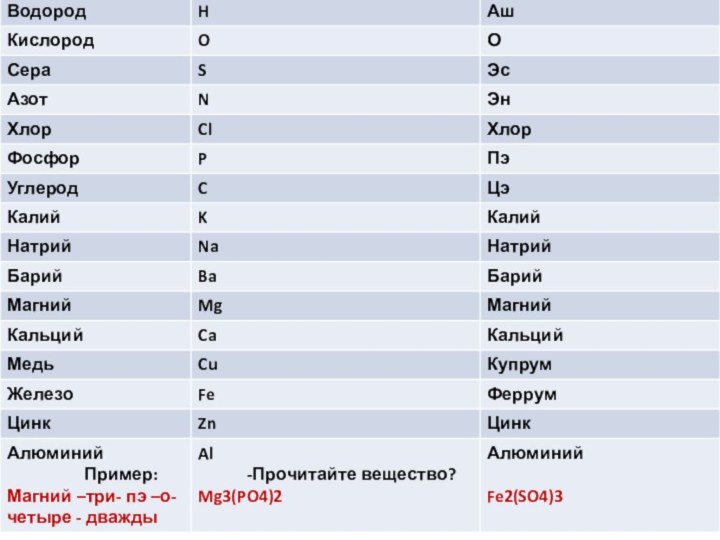
Выучить знаки ,название и как читаются элементы(это химическая азбука)См. дальше
Слайд 5
-Выполните аналогичное задание , используя формулы:
Вариант №1
4 H 2SO4
2 NaOH
3 Ba 3(PO 4)2
Вариант №2
4 H 2CO3
3 Ba(OH)2
2 K 3PO4
Слайд 6
Относительная молекулярная масса
Относительная молекулярная масса образуется в результате
сложения атомных масс элементов , умноженных на число их
атомов в молекуле(атомные массы в периодической таблице)
Ar(Fe)=56 а.е.м Mr(Fe2(CO3)3) =(56x2)+(12x3)+(16x9)=304 а.е.м
Ar(C)=12 а.е.м
Ar(O)=16 а.е.м
-Вычислите относительные молекулярные массы веществ:
а) Cu(NO3)2 б) Mg3(PO4)2 в) Al2O3
Слайд 7
Строение атома. Образование ионов
Атом состоит из положительно заряженного
ядра (заряд равен числу порядкового номера в периодической таблице)
и вращающихся по орбиталям отрицательно заряженных электронов. Число электронов равно числу заряда ядра(«+» на «-»= 0) поэтому атом нейтрален.
0
Li
Если атом отдает или принимает электроны, он превращается в заряженную частицу, которая называется ионом. Положительно заряженные ионы
+2 -3
Называются катионами (Са ), отрицательно заряженные ионы анионами( N )
0 +1 0 -2
Li - 1e Li ( катион ) S +2e S (анион)
Литий отдает 1 электрон Сера принимает 2 отрицательных электрона
-------------------------------------------- -Напишите отдал или принял атом магния электроны:
+3 -1е +3 0 +2 +2 0
2е 1е 2е 0 Mg Mg Mg Mg
(+3+(-3е)=0) (+3+(-2е)=+1)
3
Слайд 8
Задание из ЕГЭ
Одинаковое число электронов содержат частицы:
3+
–3
1) Al и N ( у алюминия 13 заряд ядра, 3+ означает , что ушли 3 электрона, значит =10 , 10 электронов осталось ; у азота заряд ядра 7, -3 означает что атом принял 3 отрицательных электрона ,получилось 10)
2+ +5
2) Ca и Cl (20-2=18 ; 17-5=12)
0 -
3) S и Cl (16; 17+1=18)
-3 -3
4) N и Р (7+3=10; 15+3=18)
Ответ: №1
-В тестовых заданиях ЕГЭ, выполните все аналогичные
Слайд 10
Степень окисления
Заряд иона показывает степень окисления, она может

быть положительной(+3), отрицательной(-2) или равна нулю(0).(она численно равна валентности).За
счет нее образуются молекулы. +3 -2
Например формула оксида алюминия : Al 2 O3
Чтобы составить формулу надо :1)определить степени окисления, 2)умножить их (+3ч(-2) =6) ; 3). произведение делить на собственную степень окисления, полученное число будет показывать число атомов этого элемента в формуле(6:3=2; атома алюминия в формуле, 6:2=3 атома кислорода в формуле.
Степень окисления можно определить по периодической таблице (Смотрите!).
Таблица состоит из горизонтальных рядов-периодов(их7).Вертикальных столбцов –это группы (их 8). Группа состоит из главной подгруппы(А) (начинается сверху с1 периода(закройте карандашом 4главную подгруппу : C, S i,Ge, Sn, Pb )и побочной(Б)(начинается ниже с больших периодов, закройте карандашом 4 побочную подгруппу: Ti, Z r, Hf, Rf)
Элементы ,находящиеся в главных подгруппах имеют степень окисления равную номеру группы, если стоят на первом месте в формуле, если элемент стоит на втором месте , то степень окисления будет равна числу ,не хватающему до 8 от номера группы в которой находится.
+6 -2 +6 -2 +1 -2 +5 -2 +2 -3
S 2 O 6 (сокращаем атомы на 2) S O3 ; Na2 S N2 O 5 ; Zn3 N2
- Закрепите материал выполнив задание( см. дальше)
Слайд 11
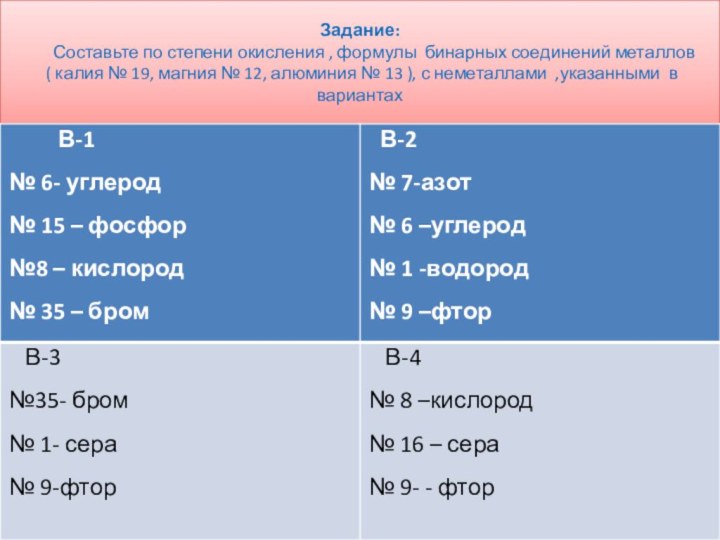
Задание:
Составьте по степени окисления
, формулы бинарных соединений металлов
( калия №
19, магния № 12, алюминия № 13 ), с неметаллами ,указанными в вариантах
Слайд 13
Классы неорганических веществ
-Выучите наизусть(сделайте шпаргалку)
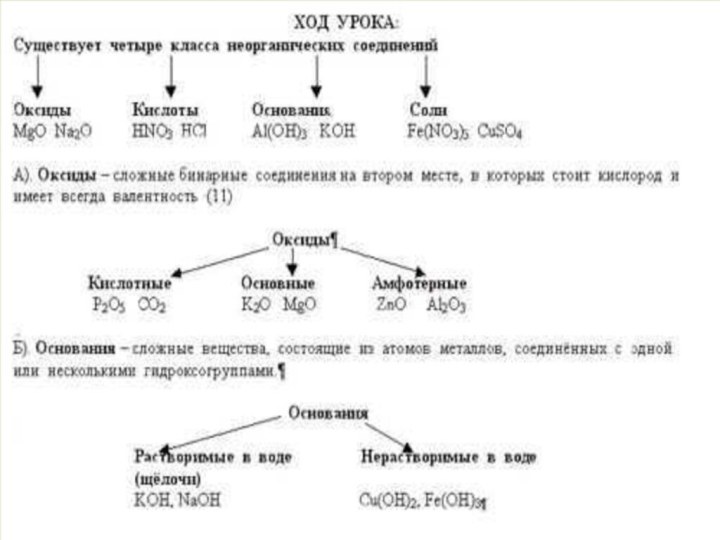
Классы неорганических соединений.
1.Оксиды-

сложные неорганические вещества состоящие из 2 элементов , один
из которых кислород Оксиды делятся на :
1) Основные (образованны металлами) Например: К2О, СиО, MgO,FeO
2)Кислотные (образованны неметаллами) .Например: SO2 , P2O5 , N2O5
-----------------------------------------------------------------------------------------------------------------------------
2.Основания (или по другому – гидроксиды)- это сложные неорганические вещества состоящие из атомов металла и одной или нескольких гидроксильных групп.(в зависимости от валентности).Основания делятся на:
1)Растворимые основания (щелочи) образованны металлами 1, 2 главных подгрупп.
Например: NaOH, Ba(OH)2 , KOH
2) Нерастворимые основания ,образованны типичными металлами. Например: Al(OH)3, Zn(OH)2, Fe(OH)3,
-------------------------------------------------------------------------------------------------------------------------------
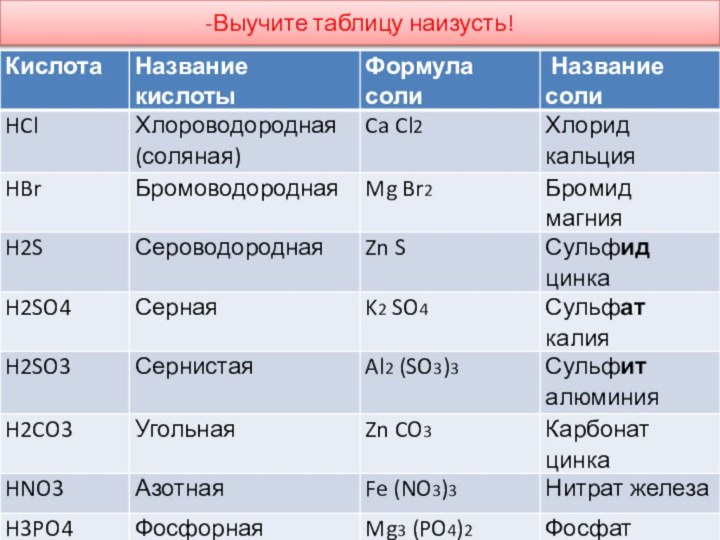
3.Кислоты- это сложные вещества состоящие из атомов водорода и кислотных остатков
Делятся на :1)Одноосновные- 1 атом водорода HCl, HNO3
2)Двухосновные -2 атома водорода H2S, H2SO4 , H2CO3
3) Трехосновные – 3 атома водорода H3PO4 H3BO3
-------------------------------------------------------------------------------------------------------------------------4.Соли – это сложные вещества , состоящие из атомов металла и кислотного остатка.
Например: Mg SO4 ,Ca 3 (PO4)2, NaCl
Слайд 15
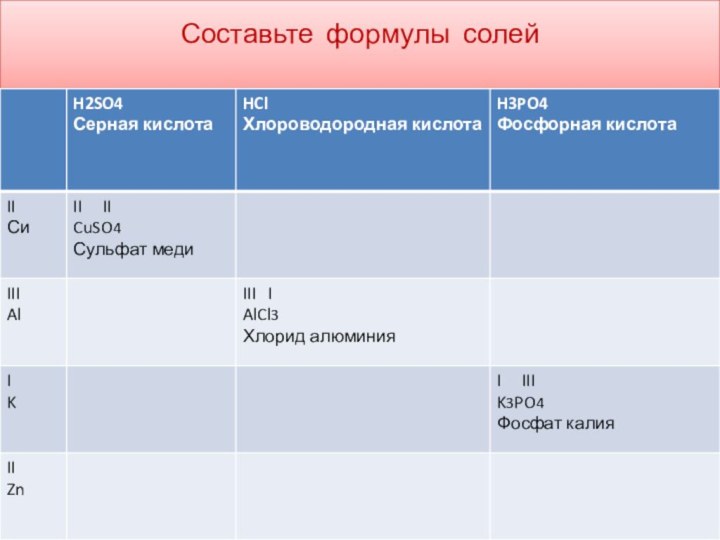
Составление формул кислот и солей
Для
того чтобы составить формулы молекул кислот и солей надо
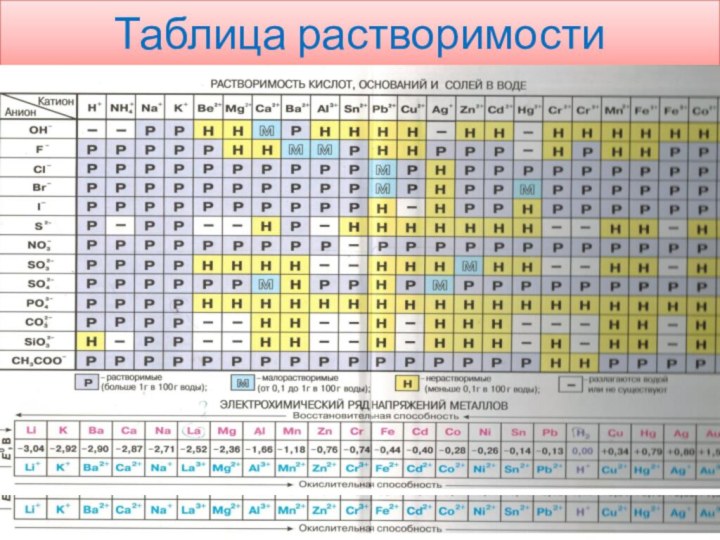
учитывать валентность кислотных остатков( их воспринимаем как целостную ,неделимую частицу , можно определить по таблице растворимости, первый вертикальный столбец, степень диссоциации , цифры маленькие сбоку вверху, численно равны валентности кислотного остатка ( - -2 - 3,
NO3 SO3 PO4 )
I II II III II I
H2SO3 Mg 3(PO4)2 Cu(NO3)2
угольная кислота фосфат магния нитрат меди
-Познакомьтесь с таблицей растворимости!
(См дальше)
Слайд 18
Задания ЕГЭ Кислые соли
Кислые соли - соли, в
которых не все атомы водорода замещены атомами металла. Например:
дигидрофосфат кальция Са(Н2РО4)2
(Валентность кислотного остатка равна числу замещенных атомов водорода-1)
1.Среди перечисленных веществ найдите кислые соли :
А) NaHCO3
Б) HCOOH
В) (NH4)2SO4
Г) KHSO4
Д) Na2HPO3
Е) Na3PO4
1) АГД 2)АВЕ 3)БДЕ 4)ВДЕ
Слайд 19
Определение степени окисления в кислотах, основаниях, солях
+2 +4 -2
Fe1 C O3
1.Расставляем степени окисления первого и последнего элементов
2.Перемножаем числа верх на низ последнего элемента(-2х3=6) и первого(+2х1=2)
3.От первого произведения вычитаем второе и получаем степень окисления среднего
элемента(6-2=4)
+2 +5 -2
Zn3 (P O4)2
Если со скобками формула , то умножаем еще на число за скобкой , а потом общее число делим на него же т.к. два атома фосфора
( -2 х4) х2 =16
+2 х3 =6
16- 6 =10
10: 2 = 5
Слайд 20
Задания ЕГЭ
1. В каком веществе степень окисления азота
равна +5:
NO2 2) NH3 3) HNO3
4) HNO2
2.В каком веществе хлор проявляет низшую степень окисления -1:
1) КClO3 2) HClO3 3) СаCl2 4) Mg(ClO4)2
3.Какой элемент в соединениях может проявлять и положительную и отрицательную степень окисления:
1)гелий 2)фтор 3) хлор 4) литий
4.Электронную конфигурацию инертного газа имеет ион:
3 + - 2 + 2+
Fe 2) Cl 3)Cu 4)Fe
2 2 6
5.Электронная конфигурация 1s 2 s p Соответствует иону:
3 + 3+ 2 + 3+
1) Al 2) Fe 3) Zn 4) Cr
Слайд 21
Моль- количество вещества.
Вещества можно измерять в граммах, килограммах,
тонах. А можно измерять в молях, за основу взяв
массу атомов, так 1 моль любого
23
вещества содержит 6х10 частиц(атомов или молекул , это число Авогадро ) т.к. атомы имеют разную массу , то и 1 моль разных веществ будут разные.
Аr(С)=12а.е.м. Аr(К)=39а.е.м Аr(Fe)=56 а.е.м. Мr(ZnО)=81а.е.м.
Можно высчитать по формуле (n- количество вещества «ню»):
m
n= ---------
M -Решите задачи:
1моль
С
1моль
К
1моль
Fe
1моль
ZnO