ТЕМА: «АЗОТНАЯ КИСЛОТА И ЕЕ СВОЙСТВА»
ЦЕЛЬ УРОКА: РАССМОТРЕТЬ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ И ОБЛАСТИ ЕЕ ПРИМЕНЕНИЯ
Слайд 3
ПЛАН УРОКА:
1.
ПРОВЕРКА ЗНАНИЙ (ПИСЬМЕННО)
2. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА;
3. ЗАКРЕПЛЕНИЕ;
4. ПОДВЕДЕНИЕ ИТОГОВ;
Слайд 5
ЗАДАНИЕ № 1
ЗАПИШИТЕ ФОРМУЛУ СОЕДИНЕНИЯ АЗОТА И ЕГО
НАЗВАНИЕ НА ОСНОВАНИИ ФИЗИЧЕСКИХ СВОЙСТВ
Бесцветный газ с
характерным резким запахом, хорошо растворим в воде, легче воздуха.
NH3 - аммиак
Слайд 6
ЗАДАНИЕ № 2
РАСПОЛОЖИТЕ СОЕДИНЕНИЯ АЗОТА В ПОРЯДКЕ ВОЗРАСТАНИЯ
СТЕПЕНЕЙ ОКИСЛЕНИЯ.
N2, NH3, KNO3, NO, HNO2.
-3
0 +2 +3 +5
NH3, N2, NO, HNO2, KNO3.
Слайд 9
Монах-алхимик Бонавентура в 1270 году в поисках универсального
растворителя «алкагеста» решил нагреть смесь железного купороса с селитрой.
Сосуд, в котором была смесь, вскоре наполнился красно-бурым «дымом». Монах в изумлении застыл, затем убрал огонь и увидел, как в колбу-приемник стала капать желтоватая жидкость. Она действовала на все металлы, даже на серебро и ртуть. Алхимики думали, что сидящий в жидкости рыжий дым является демоном, управляющим одной из стихий природы – водой. Поэтому желтоватую жидкость называли «крепкой водой» или «крепкой водкой». Это название сохранилось до времен М. В. Ломоносова. Как сейчас называют это вещество?
Слайд 10
2 FeSO4 · 7Н2О + 4 КNO3 =
Fe2О3 + 2 К2SO4 + +2НNO3 +13Н2О +2NO2
Слайд 12
АЗОТНАЯ КИСЛОТА
HNO3
I. Физические свойства азотной кислоты;
II.
Получение в лаборатории;
III. Химические свойства ;
IV. Применение азотной кислоты.
Слайд 13
I. ФИЗИЧЕСКИЕ СВОЙСТВА
АЗОТНОЙ КИСЛОТЫ
Агрегатное состояние – жидкость;
Цвет – отсутствует;
Запах – едкий, кислотный;
Растворимость в воде
– хорошая;
«Дымит» на воздухе;
«Особые приметы»:
при хранении на свету разлагается, приобретая желтоватый оттенок:
4HNO3=4NO2↑ + O2↑ + 2H2O
Слайд 16
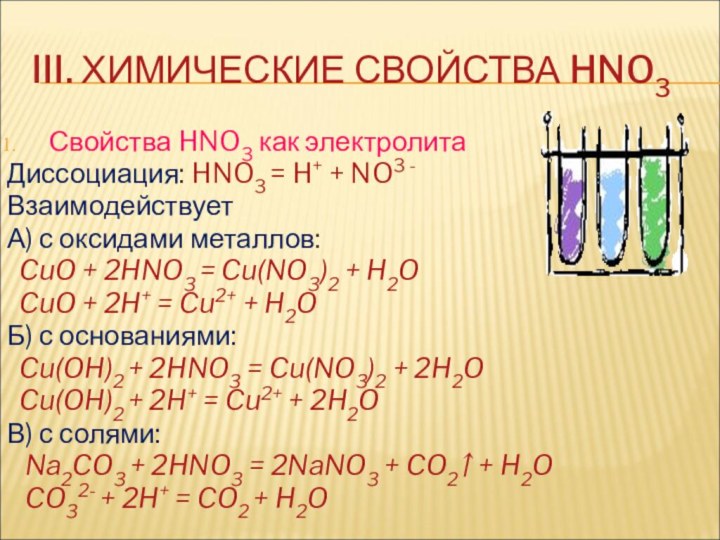
III. ХИМИЧЕСКИЕ СВОЙСТВА HNO3
Свойства HNO3 как электролита
Диссоциация: HNO3
= H+ + NO3 -
Взаимодействует
А) с оксидами металлов:
CuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ = Cu2+ + H2O
Б) с основаниями:
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
В) с солями:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
CO32- + 2H+ = CO2 + H2O
Слайд 18
III. ХИМИЧЕСКИЕ СВОЙСТВА HNO3
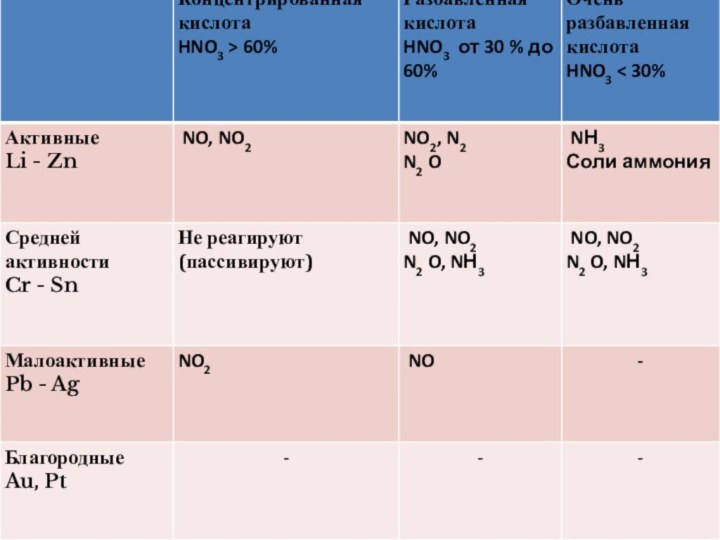
2. Окислительные свойства
Взаимодействует с металлами:
K
Ca Na Mg Al Zn Cr Fe Pb H2 Cu Hg Ag Au
Ме + HNO3 → Me(NO3)n + H2O + NxOy
Cu + 4HNO3(конц) = Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 4H2O + 2NO↑
Me + HNO3 = Me(NO3)2 + H2↑
Слайд 19
ДЕЙСТВИЕ НА ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Белки при взаимодействии с концентрированной
азотной кислотой разрушаются и приобретают жёлтую окраску .
Под действием
азотной кислоты воспламеняются бумага, масло, древесина, уголь.
Слайд 20
IV. ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
HNO3
Слайд 21
ВОПРОСЫ НА ЗАКРЕПЛЕНИЕ
I. Характерные свойства чистой HNO3:
Твердое
агрегатное состояние;
Хорошая растворимость в воде;
Отсутствие запаха;
Желтый цвет;
Разлагается на свету
с выделением азота;
«Дымит» на воздухе.
ЗАКРЕПЛЕНИЕ
II. Азотную кислоту применяют для определения примесей в золотых
изделиях. Объясните, чем в ряде случаев обуславливается появление бурого газа и голубого раствора при обработке золота кислотой?
ПОРА ПОДВЕСТИ ИТОГ!
Что я узнал
о свойствах азотной кислоты?
Где применяется азотная кислота?
Слайд 25
ОЦЕНКА МОЕЙ РАБОТЫ НА УРОКЕ
Проверка знаний -1 балл
Активность
на уроке:
самостоятельная запись уравнений-1 балл
правильные и полные ответы-1
балл
Закрепление знаний- 2 балла