- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Строение и реакционная способность. Взаимное влияние атомов в молекуле, электронные эффекты заместителей.
Содержание
- 2. Виды химической связи
- 3. Виды химической связиКакие виды химических связей есть в следующих соединениях?
- 4. Виды химической связиКакие виды химических связей есть в следующих соединениях?Ковалентная неполярнаяКовалентная полярная
- 5. Что такое электроотрицательность?это свойство, характеризующее способность атома того или элемента притягивать электроны
- 6. Как изменяется электроотрицательность элементов в ПСХЭ Д.И.Менделеева?
- 7. Как изменяется электроотрицательность элементов в ПСХЭ Д.И.Менделеева?
- 8. Как Вы думаете, какой заряд сосредоточен на
- 9. δ+δ+δ+δ+δ+δ+δ+δ-δ-δ-δ-δ-δ-δ-Электронные смещения изображают стрелками: прямой – по
- 10. Влияние заместителя (атома или группы атомов) на
- 11. Индуктивный эффектИндуктивный эффект - это эффект (от
- 12. Индуктивный эффектИндуктивное влияние заместителя уменьшается с расстоянием!!!,
- 13. Индуктивный эффектследует учесть, что в зависимости от
- 14. Задание 1Укажите, какой индуктивный эффект оказывают заместители, выделенные красным цветом
- 15. Задание 1Укажите какой индуктивный эффект оказывают заместители, выделенные красным цветом-I+I-I-I+I-I-I+I-I
- 16. Мезомерный эффектМезомерный эффект - это поляризующее влияние
- 17. Мезомерный эффектМезомерный эффект проявляется в тех случаях,
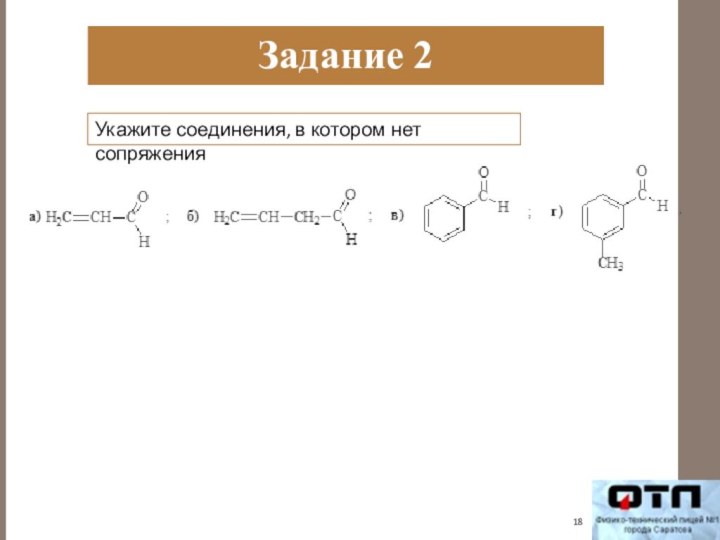
- 18. Задание 2Укажите соединения, в котором нет сопряжения
- 19. Задание 2Укажите соединения, в котором нет сопряжения
- 20. Задание 2Укажите соединения, в котором нет сопряжения
- 21. Задание 2Укажите соединения, в котором нет сопряжения
- 22. Задание 3Укажите соединения, в которых имеется π,π -сопряжение
- 23. Задание 3Укажите соединения, в которых имеется π,π -сопряжение
- 24. Задание 3Укажите соединения, в которых имеется р,π -сопряжение
- 25. Задание 3Укажите соединения, в которых имеется р,π -сопряжение
- 26. Мезомерный эффектВ отличие от индуктивного эффекта, мезомерный
- 27. Мезомерный эффектПоложительный мезомерный эффект (+М) проявляют:обратить внимание на номера групп, в которых расположены центральные элементов:
- 28. Мезомерный эффектОтрицательный мезомерный эффект (-М) проявляют группы, содержащие полярные ненасыщенные связи:
- 29. Задание 4Укажите, какой мезомерный эффект оказывают заместители, выделенные красным цветом
- 30. Задание 4Укажите какой мезомерный эффект оказывают заместители, выделенные красным цветом+М+М+М
- 31. Мезомерный эффектВ сопряжённых молекулах мезомерный эффект проявляется
- 32. Мезомерный эффектПри несовпадении знаков индуктивного и мезомерного эффектов заместителей учитывают их суммарное действие.
- 33. Мезомерный эффектЭлектронодонорные заместители – заместители, повышающие электронную
- 34. Задание 5Укажите соединения, в которых ОН-группа является электронодонорным заместителем:
- 35. Задание 5Укажите соединения, в которых ОН-группа является электронодонорным заместителем:
- 36. Задание 6Укажите соединения, в которых NH2-группа является электроноакцепторным заместителем
- 37. Задание 6Укажите соединения, в которых NH2-группа является электроноакцепторным заместителем
- 38. ГиперконъюгацияГиперконьюгация (сверхсопряжение, σ,π-сопряжение) - наблюдаемый экспериментальный эффект
- 39. Строение углеводородного радикалаСвободными радикалами называют интермедиаты, в
- 40. Строение карбокатионаКарбокатионы, или карбениевые ионы, представляют собой
- 41. Кислоты и основания
- 42. Слабые электролитыДля слабых электролитов кислотность количественно оценивается
- 43. Органические кислотыСила кислоты определяется стабильностью образующегося аниона.
- 44. Делокализация зарядаОт электроотрицательности (ЭО) гетероатома.
- 45. От характера заместителя R (длины его, наличие
- 46. От введения заместителей в радикал. ЭА заместители
- 47. Кислотность алифатических кислот Заместитель влияет особенно сильно,
- 48. Кислотность алифатических кислот Для дикарбоновых кислот, чем
- 49. Кислотность ароматических кислот Бензойная кислота
- 50. Кислотность алифатических кислот Сила кислоты возрастаетСила кислоты возрастает
- 51. Заместитель, обладающий –М и –I-эффектами (нитрогруппа), проявляет
- 52. Сила основанийСила основания определяется стабильностью образующегося катиона.
- 53. Электрофильное гидробромирование несимметричных алкеновВ отличие от симметричных
- 54. Эффект ХарашаРадикальное гидробромирование алкеновПрисоединение бромистого водорода к
- 55. Эффект ХарашаПрисоединение бромистого водорода, инициируемое кислородом или
- 56. Аномальное гидрогалогенирование, инициируемое перекисями, характерно для присоединения
- 57. Скачать презентацию
- 58. Похожие презентации










































Слайд 4
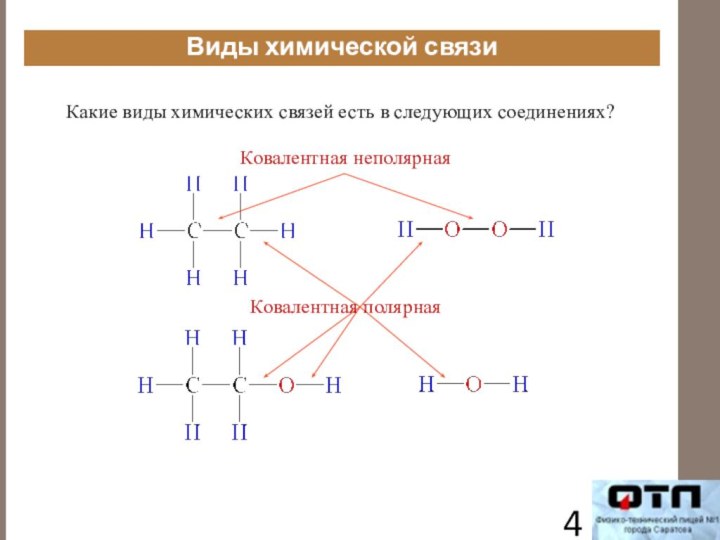
Виды химической связи
Какие виды химических связей есть в
следующих соединениях?
Ковалентная неполярная
Ковалентная полярная
Слайд 5
Что такое электроотрицательность?
это свойство, характеризующее
способность атома того
или элемента
притягивать электроны
Слайд 8 Как Вы думаете, какой заряд сосредоточен на более
электроотрицательном атоме в ковалентной полярной связи?
А на менее электроотрицательном?
отрицательный
положительный
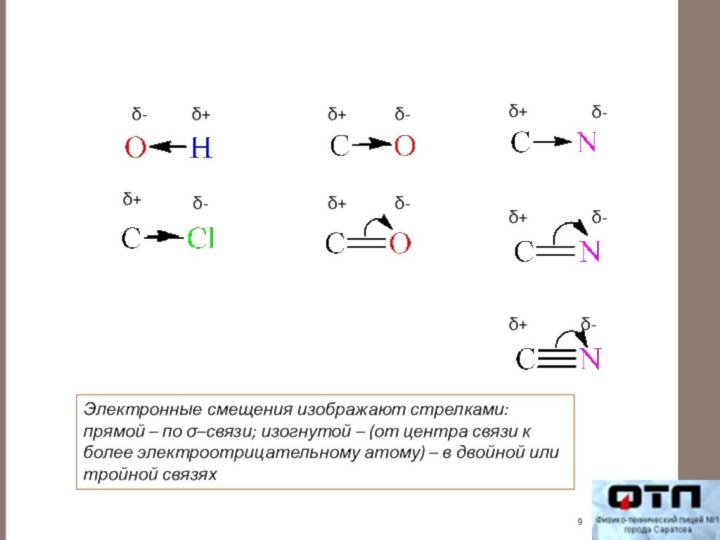
Электронные
смещения возникают как в одинарных (простых), так и в двойных (тройных) связях и приводят к возникновению частичных (долевых) зарядов (δ+, δ–) - полярная связь.
Слайд 9
δ+
δ+
δ+
δ+
δ+
δ+
δ+
δ-
δ-
δ-
δ-
δ-
δ-
δ-
Электронные смещения изображают стрелками: прямой – по σ–связи;
изогнутой – (от центра связи к более электроотрицательному атому)
– в двойной или тройной связяхСлайд 10 Влияние заместителя (атома или группы атомов) на распределение
электронной плотности в органической молекуле описывают с помощью электронных
эффектов.Заместитель также испытывает на себе влияние остатка молекулы, к которому он присоединён.
Различают:
индуктивный (I);
мезомерный (М) эффект;
эффект сверхсопряжения (гиперконьюгация, σ,π-сопряжение)
Слайд 11
Индуктивный эффект
Индуктивный эффект - это эффект (от латинского
effectus – действие) поляризующего влияния заместителя, проявляющийся в смещении
электронной плотности вдоль σ-связей.Если заместитель (по сравнению с водородом!!!) увеличивает электронную плотность (δ-) в углеродной цепи атомов, эффект называют положительным и обозначают +I (донорный заместитель).
Если заместитель оттягивает электроны на себя (акцепторный заместитель), атомы углерода в цепи оказываются заряженными положительно (δ+), эффект называют отрицательным и обозначают -I.
То есть знак эффекта совпадает со знаком заряда, возникающим на атоме в результате поляризации связи.
Слайд 12
Индуктивный эффект
Индуктивное влияние заместителя уменьшается с расстоянием!!!, т.е.
максимальное воздействие оказывается на атом связанный с электронодонорной или
акцепторной группойδ4+
δ3+
δ2+
δ1+
δ-
+I группы С4Н9
-I атома Cl
δ3+<< δ2+< δ1+; δ4+≈0
Слайд 13
Индуктивный эффект
следует учесть, что в зависимости от типа
гибридизации электроотрицательность атома углерода будет отличаться
ЭО Сsp> ЭО Csp2>
ЭО Csp3+I –эффект алкильных заместителей уменьшается в ряду:
Слайд 14
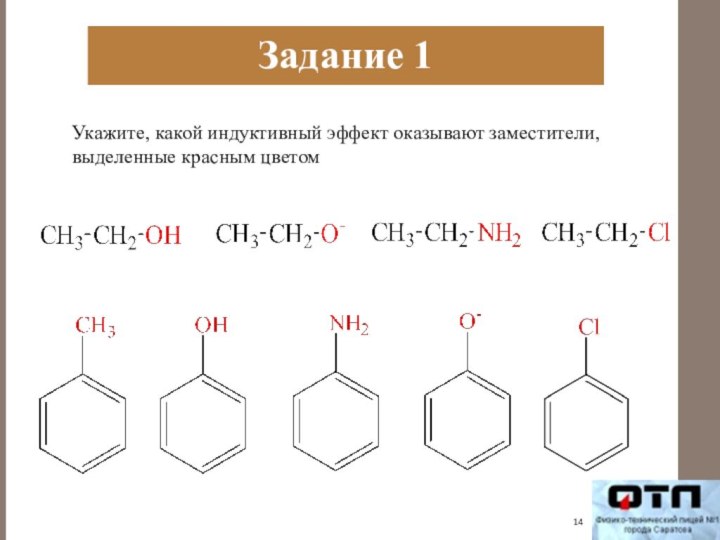
Задание 1
Укажите, какой индуктивный эффект оказывают заместители,
выделенные
красным цветом
Слайд 15
Задание 1
Укажите какой индуктивный эффект оказывают заместители,
выделенные
красным цветом
-I
+I
-I
-I
+I
-I
-I
+I
-I
Слайд 16
Мезомерный эффект
Мезомерный эффект - это поляризующее влияние заместителя,
проявляющиеся в смещении электронов π-связей или неподелённых электронных пар
отдельных атомов сопряженной системы (О, S, N)В результате на противоположных концах сопряжённой системы появляются одинаковые по величине, но разные по знаку заряды.
Слайд 17
Мезомерный эффект
Мезомерный эффект проявляется в тех случаях, когда
в молекуле имеется система сопряжённых связей (π,π или р,π)(только
в них!!!), т.е. в алкеновых, полиеновых, алкиновых, ароматических и гетероциклических соединениях
Слайд 26
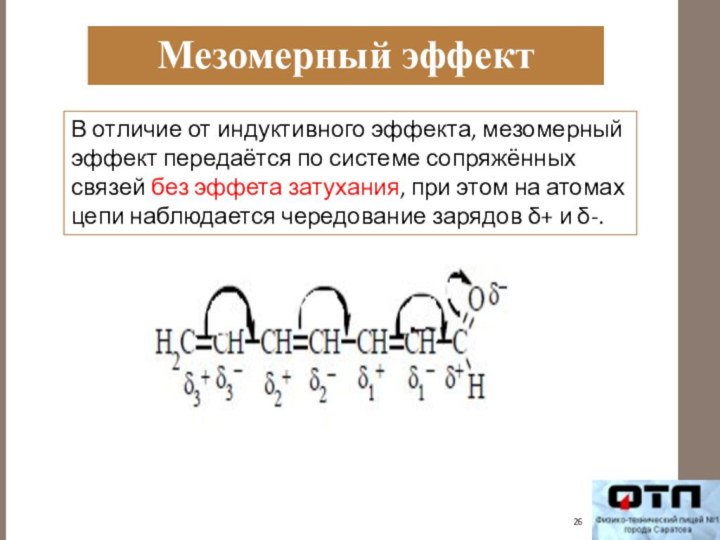
Мезомерный эффект
В отличие от индуктивного эффекта, мезомерный эффект
передаётся по системе сопряжённых связей без эффета затухания, при
этом на атомах цепи наблюдается чередование зарядов δ+ и δ-.
Слайд 27
Мезомерный эффект
Положительный мезомерный эффект (+М) проявляют:
обратить внимание на
номера групп, в которых расположены центральные элементов:
Слайд 28
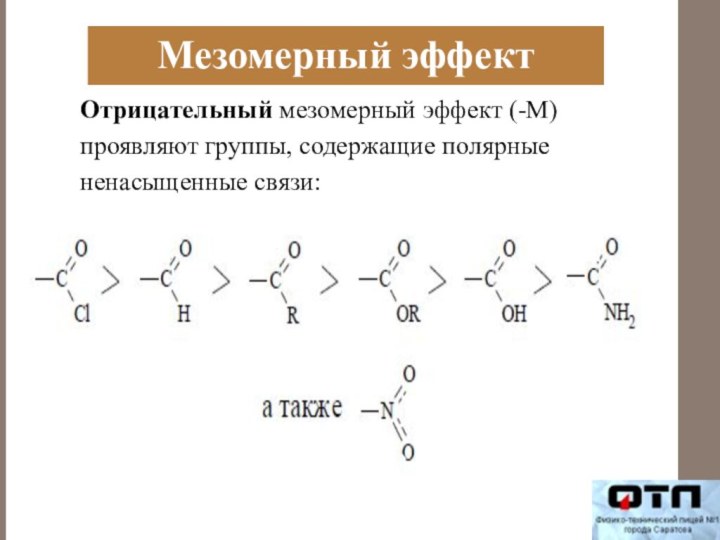
Мезомерный эффект
Отрицательный мезомерный эффект (-М) проявляют группы, содержащие
полярные ненасыщенные связи:
Слайд 30
Задание 4
Укажите какой мезомерный эффект оказывают заместители,
выделенные
красным цветом
+М
+М
+М
Слайд 31
Мезомерный эффект
В сопряжённых молекулах мезомерный эффект проявляется одновременно
с индуктивным и может либо совпадать с ним по
знаку, либо иметь противоположный знак
Слайд 32
Мезомерный эффект
При несовпадении знаков индуктивного и мезомерного эффектов
заместителей учитывают их суммарное действие.
Слайд 33
Мезомерный эффект
Электронодонорные заместители – заместители, повышающие электронную плотность
на реакционном центре в результате совокупного действия всех эффектов
Электроноакцепторные заместители – заместители, понижающие электронную плотность на реакционном центре в результате совокупного действия всех эффектов
Слайд 36
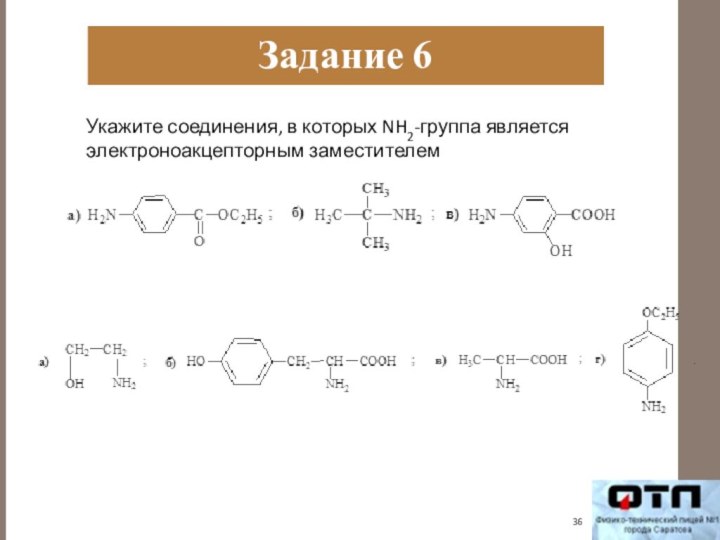
Задание 6
Укажите соединения, в которых NH2-группа является электроноакцепторным
заместителем
Слайд 37
Задание 6
Укажите соединения, в которых NH2-группа является электроноакцепторным
заместителем
Слайд 38
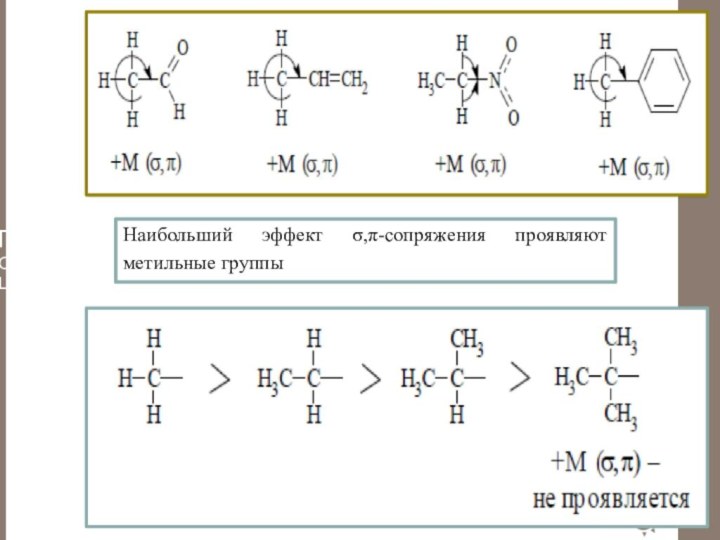
Гиперконъюгация
Гиперконьюгация (сверхсопряжение, σ,π-сопряжение) - наблюдаемый экспериментальный эффект смещения
σ-электронов С-Н связей алкильных групп, стоящих рядом с атомами
углерода в sp2- или sp-гибридизации. Электронная плотность смещается от С-Н связей в сторону ненасыщенной связи или бензольного кольца. Эффект обозначается как +М (σ,π) и изображается изогнутой стрелкой от С-Н связей на соседнюю связь.Наибольший эффект σ,π-сопряжения проявляют метильные группы
Слайд 39
Строение углеводородного радикала
Свободными радикалами называют интермедиаты, в которых
атом углерода трехковалентен и несет один "неспаренный" электрон. В
отличие от карбокатионов и карбанионов свободные радикалы электронейтральны.Свободные радикалы, подобно карбокатионам, имеют атом углерода в состоянии sp2-гибридизации, три гибридные орбитали которого используются для образования σ-связей. Четвертая, негибридная p-орбиталь, несет неспаренный электрон
Слайд 40
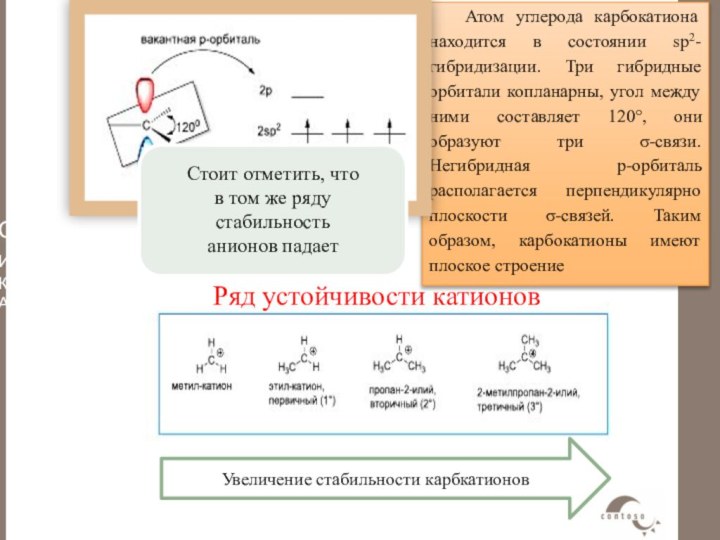
Строение карбокатиона
Карбокатионы, или карбениевые ионы, представляют собой интермедиаты,
у которых атом углерода имеет три ковалентные связи и
положительный заряд R3C+.Атом углерода карбокатиона находится в состоянии sp2-гибридизации. Три гибридные орбитали копланарны, угол между ними составляет 120°, они образуют три σ-связи. Негибридная p-орбиталь располагается перпендикулярно плоскости σ-связей. Таким образом, карбокатионы имеют плоское строение
Слайд 42
Слабые электролиты
Для слабых электролитов кислотность количественно оценивается Крав
реакции, которая заключается в переносе Н+ от кислоты к
Н2О как основанию.СН3СООН + Н2О ↔ СН3СОО- + Н3О+
кислота основание
Учитывая, что концентрация Н2О практически постоянна, определяют К кислотности (Ка). Чем больше Ка, тем сильнее кислота. Для СН3СООН Ка = 1,75·10-5. такие малые величины неудобны в практической работе, поэтому Ка выражают через рКа (рК = -ℓg Ка). Для СН3СООН рКа = 4,75. Чем меньше величина рКа, тем сильнее кислота.
Слайд 43
Органические кислоты
Сила кислоты определяется стабильностью образующегося аниона.
Чем стабильнее
анион, тем сильнее кислота. Стабильность аниона зависит от делокализации (распределения) «» заряда по всей частице (аниону). Чем больше делокализован «» заряд, тем стабильнее анион и сильнее кислота.Делокализация заряда зависит:
от электроотрицательности (ЭО) гетероатома.
от поляризуемости гетероатома.
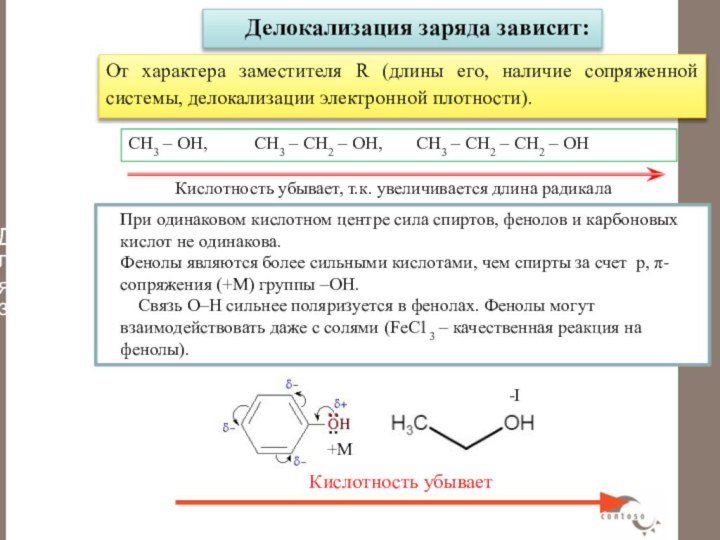
от характера заместителя R (длины его, наличие сопряженной системы, делокализации электронной плотности).
от введения заместителей в радикал.
Слайд 44
Делокализация заряда
От электроотрицательности (ЭО) гетероатома. Чем
больше ЭО гетероатома, тем сильнее соответствующая кислота.
Делокализация заряда
зависит:От поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая кислота.
Спирты более сильные кислоты, чем амины, т.к. ЭО (О) > ЭО (N).
R – ОН > R – NН2
R – SН > R – OН
Тиолы более сильные кислоты, чем спирты, т.к. атом S более поляризуем, чем атом О.
Слайд 45 От характера заместителя R (длины его, наличие сопряженной
системы, делокализации электронной плотности).
Делокализация заряда зависит:
При одинаковом кислотном центре
сила спиртов, фенолов и карбоновых кислот не одинакова.Фенолы являются более сильными кислотами, чем спирты за счет р, -сопряжения (+М) группы –ОН.
Связь О–Н сильнее поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FеС13 – качественная реакция на фенолы).
Делокализация заряда
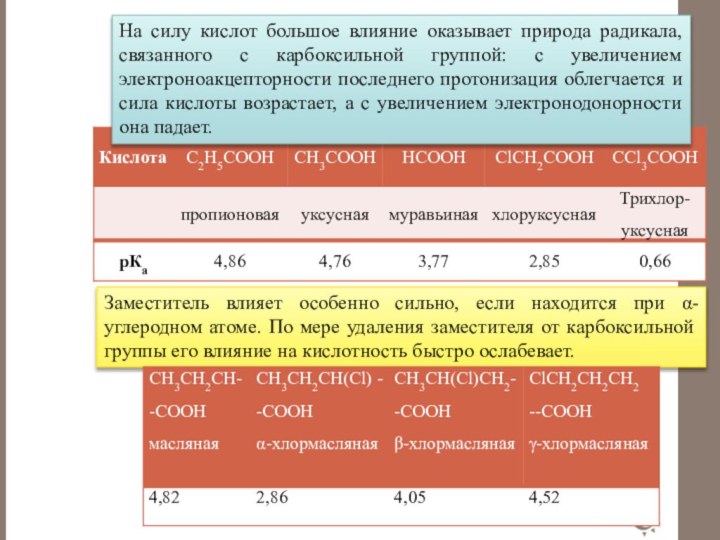
Слайд 46 От введения заместителей в радикал. ЭА заместители увеличивают
кислотность, ЭД заместители уменьшают кислотность.
Делокализация заряда зависит:
п-Нитрофенол более сильная
кислота, чем п-аминофенол, т.к. группа –NО2 является ЭА.СН3–СООН ССl3–СООН
рК 4,7 рК 0,65
Трихлоруксусная кислота во много раз сильнее уксусной за счет (– I) эффекта атомов Cl.
Муравьиная кислота сильнее уксусной и пропионовой за счет (+I) эффекта группы СН3.
Делокализация заряда
Слайд 47
Кислотность алифатических кислот
Заместитель влияет особенно сильно, если находится
при α-углеродном атоме. По мере удаления заместителя от карбоксильной
группы его влияние на кислотность быстро ослабевает.На силу кислот большое влияние оказывает природа радикала, связанного с карбоксильной группой: с увеличением электроноакцепторности последнего протонизация облегчается и сила кислоты возрастает, а с увеличением электронодонорности она падает.
Слайд 48
Кислотность алифатических кислот
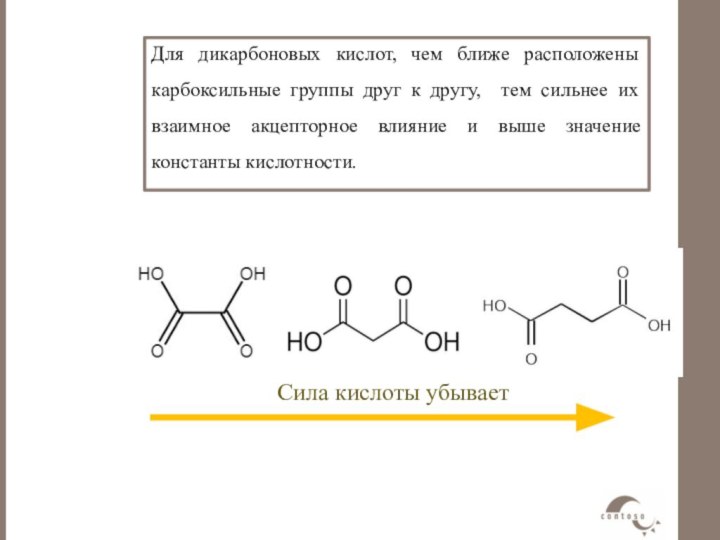
Для дикарбоновых кислот, чем ближе расположены
карбоксильные группы друг к другу, тем сильнее их взаимное
акцепторное влияние и выше значение константы кислотности.Сила кислоты убывает
Слайд 49
Кислотность ароматических кислот
Бензойная кислота является
более слабой кислотой, чем муравьиная, но более сильной, чем
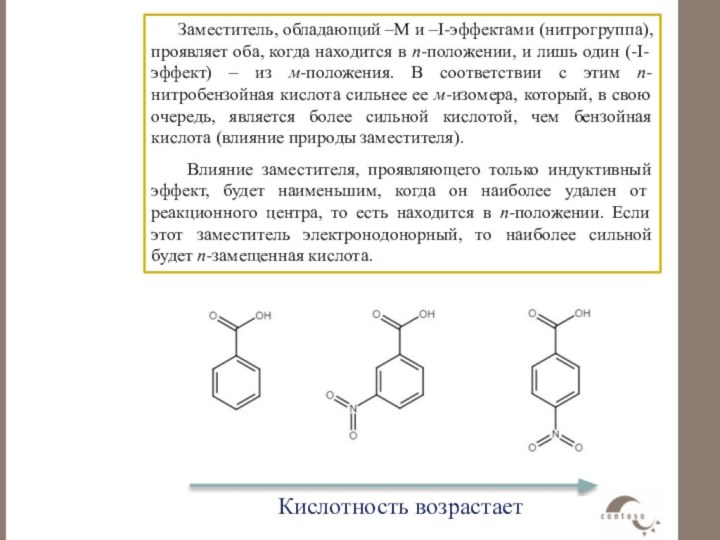
уксусная кислота.Слайд 51 Заместитель, обладающий –М и –I-эффектами (нитрогруппа), проявляет оба,
когда находится в п-положении, и лишь один (-I-эффект) –
из м-положения. В соответствии с этим п-нитробензойная кислота сильнее ее м-изомера, который, в свою очередь, является более сильной кислотой, чем бензойная кислота (влияние природы заместителя).Влияние заместителя, проявляющего только индуктивный эффект, будет наименьшим, когда он наиболее удален от реакционного центра, то есть находится в п-положении. Если этот заместитель электронодонорный, то наиболее сильной будет п-замещенная кислота.
Кислотность ароматических кислот
Слайд 52
Сила оснований
Сила основания определяется стабильностью образующегося катиона. Чем
стабильнее катион, тем сильнее основание. Другими словами, сила основания
тем больше, чем менее прочная связь с гетероатомом (О, S, N), имеющим свободную электронную пару, атакуемую Н+.Стабильность катиона зависит от тех же факторов, что и стабильность аниона, но с обратным действием. Все факторы, усиливающие кислотность, уменьшают основность.
Самыми сильными основаниями являются амины, т.к. атом азота имеет меньшую ЭО по сравнению с О. При этом вторичные амины более сильные основания, чем первичные, третичные амины слабее вторичных за счет стерического фактора, затрудняющего доступ протона к N.
Ароматические амины более слабые основания, чем алифатические, что объясняется +М группы –NН2. Электронная пара азота, участвуя в сопряжении, становится малоподвижной.
Слайд 53
Электрофильное гидробромирование несимметричных алкенов
В отличие от симметричных электрофилов
(Hal2), галогеноводороды представляют собой несимметричные электрофильные реагенты. Присоединение любого
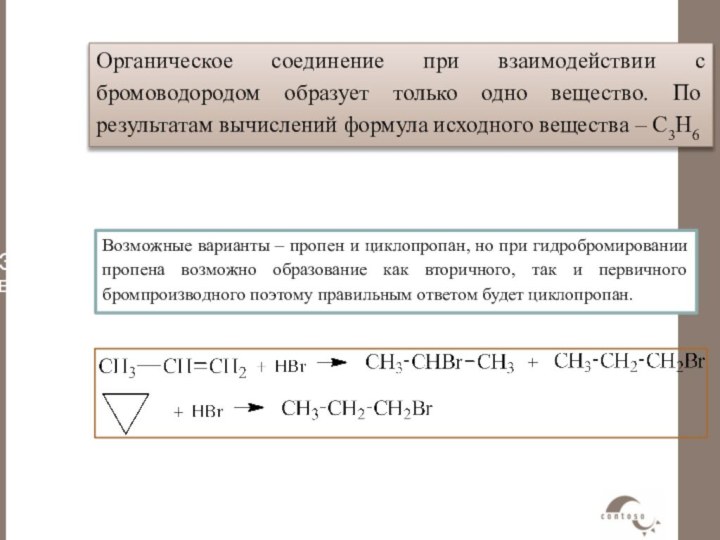
несимметричного электрофила (HBr, H2O и т.д.) к несимметричному алкену в принципе могло бы дать смесь двух альтернативных продуктов, однако на практике обычно образуется только один из них. В качестве примера рассмотрим присоединение бромистого водорода к пропилену.Еще в 1870 г. В.В.Марковников сформулировал эмпирическое правило, согласно которому несимметричные алкены присоединяют НХ таким путем, что преимущественно образуется продукт, в котором водород присоединяется к наименее замещенному концу двойной связи.
Слайд 54
Эффект Хараша
Радикальное гидробромирование алкенов
Присоединение бромистого водорода к алкенам
резко отличается от присоединения остальных галогеноводородов - HF, HCl
и HI. В зависимости от условий при присоединении HBr к несимметричным алкенам образуются продукты присоединения или в соответствии с правилом Марковникова, или против правила Марковникова. Было установлено, что при полном отсутствии кислорода или пероксидов гидробромирование алкенов строго подчиняется правилу Марковникова. Однако в присутствии кислорода или каталитических количеств пероксидов присоединение HBr осуществляется против правила Марковникова (анти-марковниковское присоединение). Наиболее эффективными инициаторами анти-марковниковского присоединения HBr к алкенам оказались пероксиды, такие как перекись бензоила (C6H5COO)2, трет-бутилгидропероксид (CH3)3COOH и др. Рациональное объяснение этого явления было дано М.Харашем (1933 г). Он показал, что механизм реакции изменяется с электрофильного на радикальный, что в свою очередь приводит к полному изменению региоселективности гидробромирования алкена.
Слайд 55
Эффект Хараша
Присоединение бромистого водорода, инициируемое кислородом или перекисями,
осуществляется по цепному радикальному механизму. Инициирование радикальной цепи заключается
в образовании атома брома, который вызывает развитие радикальной цепи.Зарождение цепи
Развитие цепи
Образование радикала Br. при зарождении цепи происходит в результате взаимодействия перекисного радикала или кислорода с бромистым водородом. Атом брома присоединяется к концевому атому углерода алкена с образованием более замещенного вторичного радикала. Аналогично карбокатионам, вторичные алкильные радикалы стабильнее первичных. Поэтому на первой стадии развития цепи образуется только вторичный, а не первичный радикал. В конечном итоге это приводит к анти-марковниковскому продукту радикального гидробромирования RCH2CH2Br.
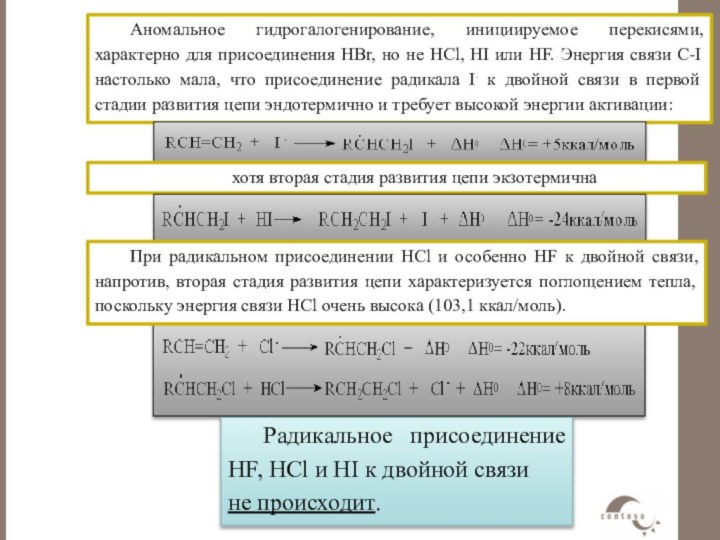
Слайд 56 Аномальное гидрогалогенирование, инициируемое перекисями, характерно для присоединения НBr,
но не HCl, HI или HF. Энергия связи С-I
настолько мала, что присоединение радикала I. к двойной связи в первой стадии развития цепи эндотермично и требует высокой энергии активации:При радикальном присоединении HCl и особенно HF к двойной связи, напротив, вторая стадия развития цепи характеризуется поглощением тепла, поскольку энергия связи HCl очень высока (103,1 ккал/моль).
Радикальное присоединение HF, HCl и HI к двойной связи не происходит.





























