Слайд 2
Цели урока
Дать план общей характеристики хим. Элемента по
его положению в ПСХЭ
Повторить строение атома, типы хим. связи,
классификацию неорганических веществ и их свойства в свете ТЭД и ОВР, генетическую связь между классами неорганических веществ
Познакомить учащихся с задачами на выход продукта реакции
Слайд 3
План характеристики ХЭ по его положению в ПСХЭ
Адрес
ХЭ
Строение атома, проявляемые свойства, сравнение с соседними элементами
Физические свойства
простого вещества
Оксид, образуемый этим ХЭ и его свойства, тип и схема хим. связи
Гидроксид, образуемый этим ХЭ, его свойства, тип связи
Водородное соединение, его свойства
Соли и их свойства
Слайд 4
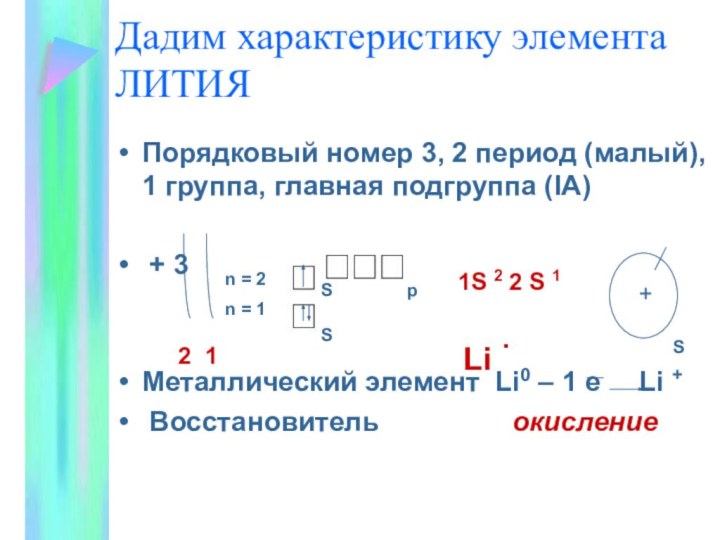
Дадим характеристику элемента ЛИТИЯ
Порядковый номер 3, 2 период
(малый), 1 группа, главная подгруппа (IA)
+ 3
Металлический элемент
Li0 – 1 e Li +
Восстановитель окисление
2 1
n = 2
n = 1
S
S
p
1S 2 2 S 1
+
S
Li .
Слайд 5
Сравним свойства атома лития с соседними ХЭ по
группе и периоду
В группе : Литий -
Натрий
На внешней оболочке – по 1 электрону (сходство)
Количество оболочек: у натрия на 1 оболочку больше, следовательно, радиус атома натрия больше, чем у лития, металлические и восстановительные свойства натрия сильнее
В периоде: Литий – Бериллий
Количество оболочек – по 2 (сходство)
Количество внешних электронов: у лития 1e, а у натрия – 2 e, следовательно, радиус атома лития больше, чем у бериллия, металлические и восстановительные свойства лития сильнее
Слайд 6
Литий – простое вещество
Щелочной металл серебристого цвета, очень
легкий, хранится под слоем керосина, не встречается в природе
в свободном виде, малиновый цвет пламени
Т пл. = 180,60, Т кип. = 13420, плотность 0,534 г/ cм3
Металлическая кристаллическая решетка
Металлическая хим. связь
Li0 – 1 e Li +
атом ион
Электропроводность, теплопроводность, ковкость, пластичность, металлический блеск, режется ножом, но на срезе быстро окисляется и темнеет из-за своей активности
Химические свойства: реагирует с водой и неметаллами (кислородом, азотом, галогенами, водородом и др.) – составить уравнения реакций
Слайд 7
Оксид лития – Li2O
Солеобразующий, основный
Ионная связь (записать схему
образования связи)
Белый цвет
Химические свойства:
Запишите реакции оксида лития
с водой, оксидом углерода (IV), соляной кислотой
Получение: Li2O2 + 2 Li = 2 Li2O
пероксид лития оксид лития
Слайд 8
Гидроксид лития - LiOH
Li+ - OH-
ионная связь
Li+
- простой ион, OH- - сложный ион
OH- - КПС
Белый
гигроскопичный порошок, мылкий на ощупь, едкий
Химические свойства: запишите реакции гидроксида лития с серной кислотой, сульфатом меди (II), оксидом углерода (IV), исключение – разложение при нагревании
Получение: электролиз расплавов галогенсодержащих солей
2 LiCl 2 Li + Cl2
Слайд 9
Водородное соединение – LiH гидрид лития
Твердый
Белый
Гигроскопичен
Используется как восстановитель
Cоли
лития
Проверить растворимость солей лития в воде по таблице растворимости
Слайд 10
Открытие лития
А.Арфведсон, 1817 г. – признал литий новым
щелочным металлом
Впервые выделен из слоистого силикатного минерала петалита LiAlSi4O10
Название
– от греческого «камень»
Г.Дэви, 1818 г., электролиз расплавленного оксида лития
Слайд 11
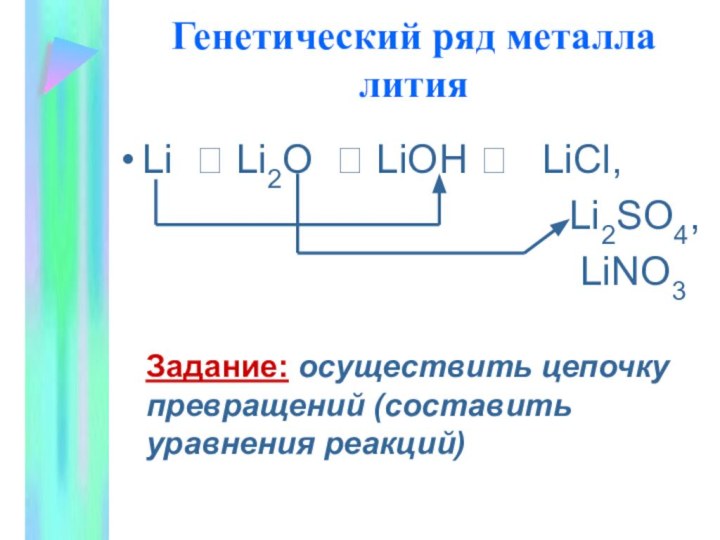
Генетический ряд металла
Вспомните признаки генетического ряда:
Один и тот
же химический элемент-металл
Разные формы существования этого элемента-металла (простое вещество-оксид-основание-соль)
Взаимопревращения
веществ разных классов