Слайд 2
(иначе насыщенные углеводороды, парафины, алифатические соединения) — ациклические
углеводороды линейного или разветвленного строения, содержащие только простые связи.
АЛКАНЫ
Слайд 3
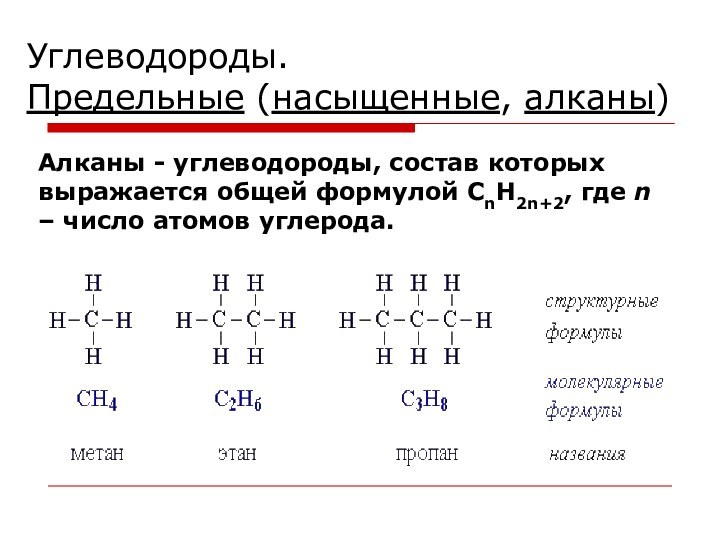
Углеводороды.
Предельные (насыщенные, алканы)
Алканы - углеводороды, состав которых
выражается общей формулой CnH2n+2, где n – число атомов
углерода.
Слайд 5
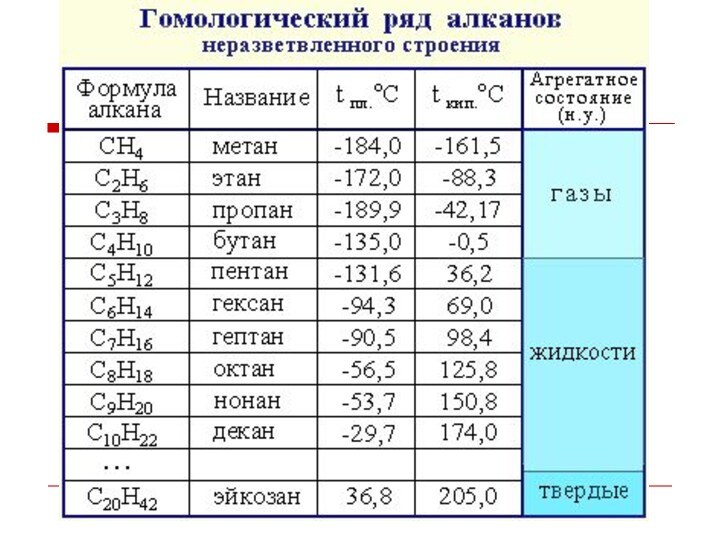
Физические свойства
Температуры плавления и кипения увеличиваются с молекулярной
массой и длиной главной углеродной цепи
При нормальных условиях
неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; после C14H30 — твёрдые тела.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Слайд 6
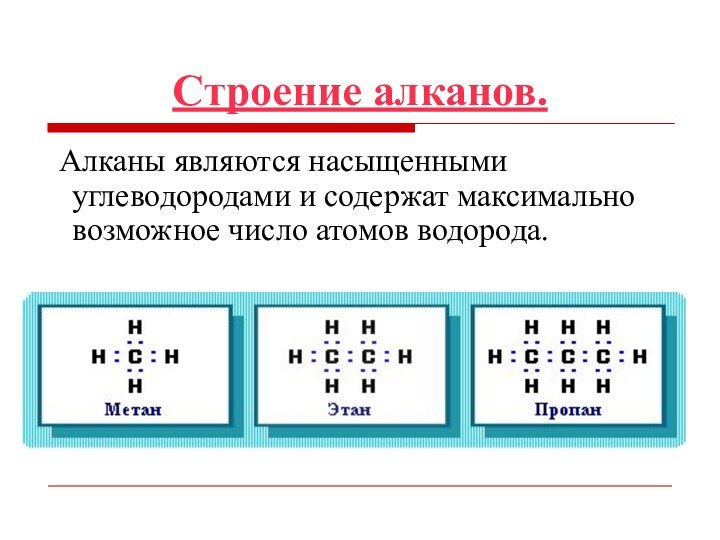
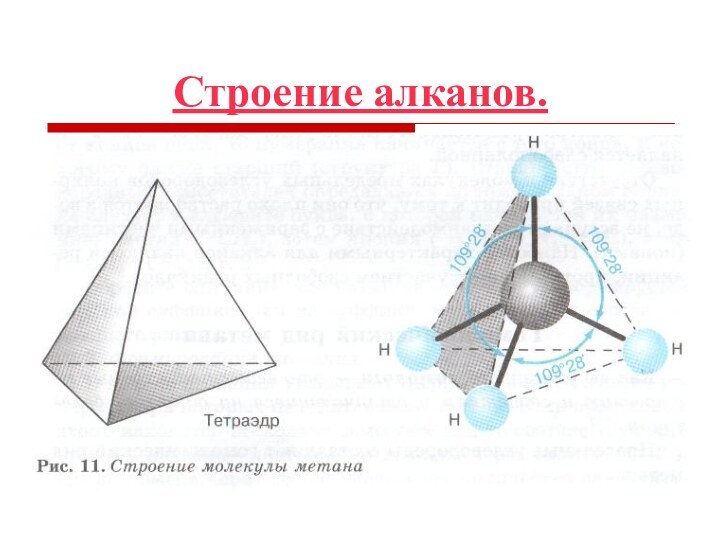
Строение алканов.
Алканы являются насыщенными углеводородами и
содержат максимально возможное число атомов водорода.
Слайд 7
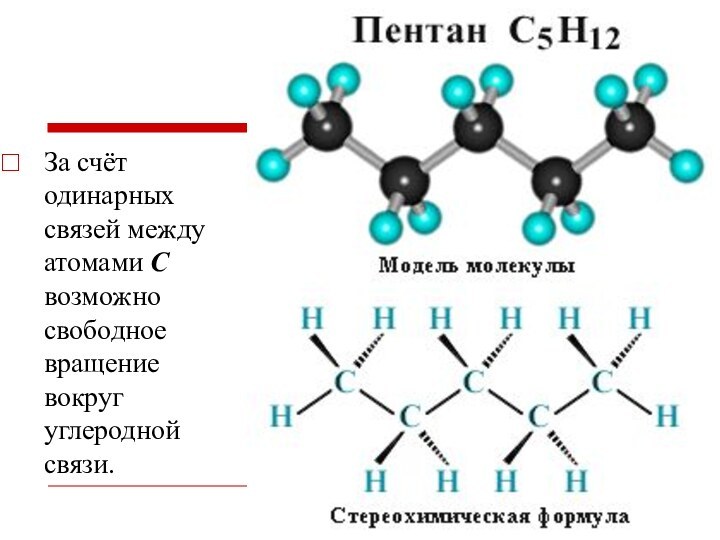
За счёт одинарных связей между атомами С возможно
свободное вращение вокруг углеродной связи.
Слайд 8
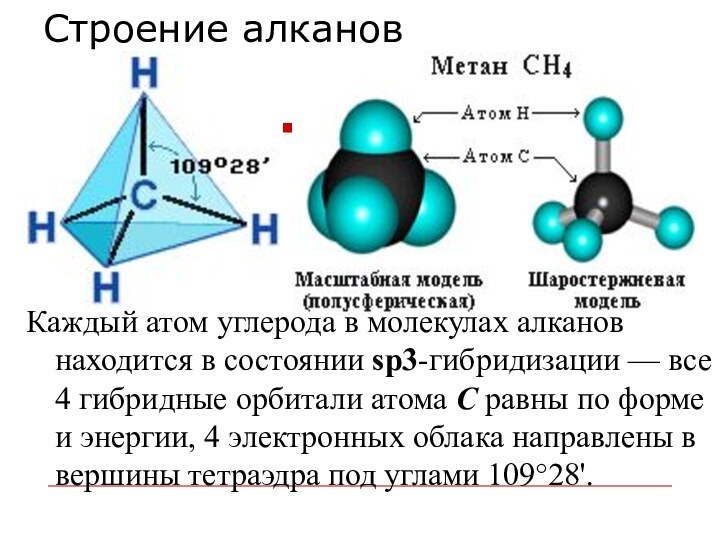
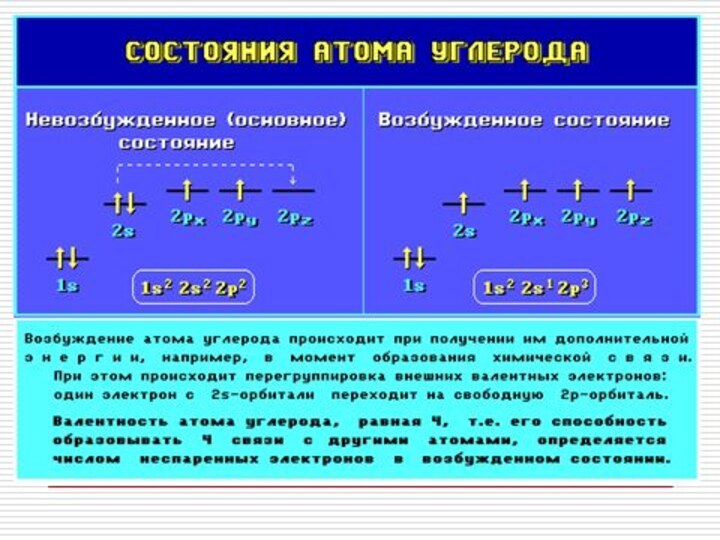
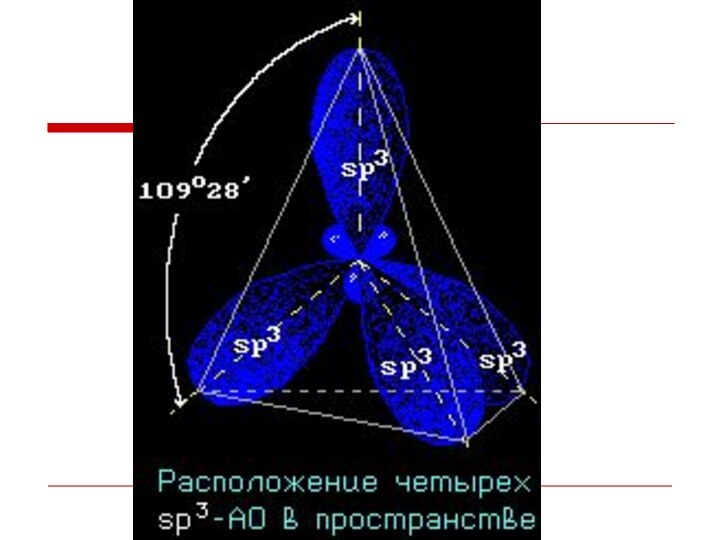
Строение алканов
Каждый атом углерода в молекулах алканов
находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома
С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'.
Слайд 11
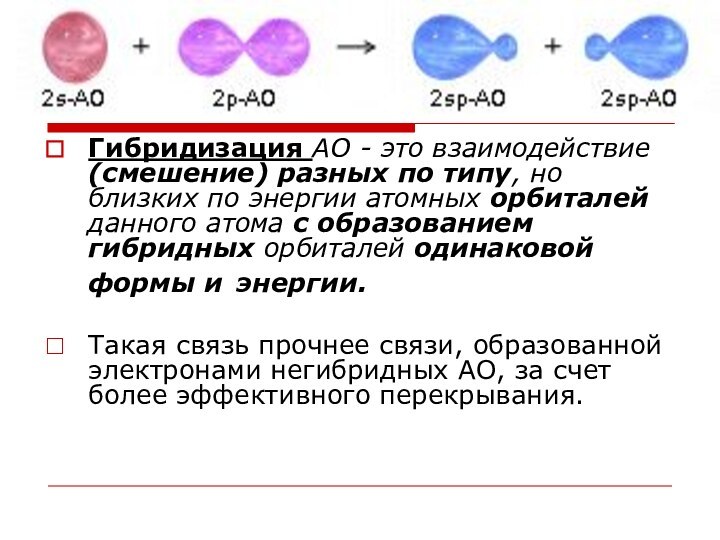
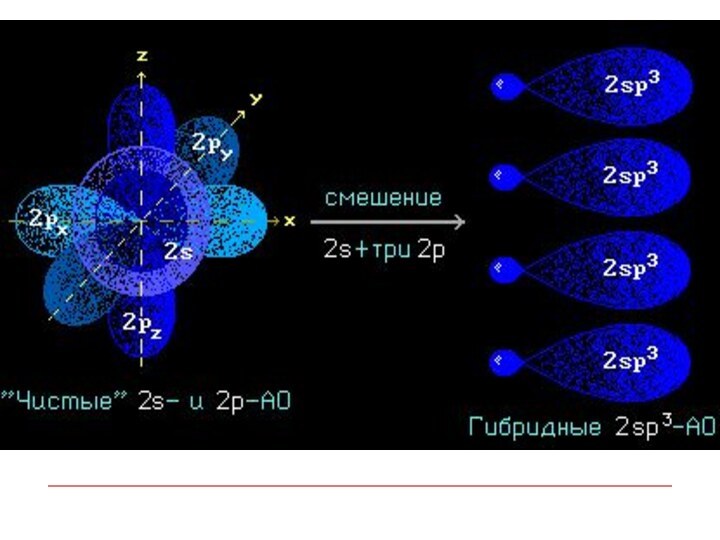
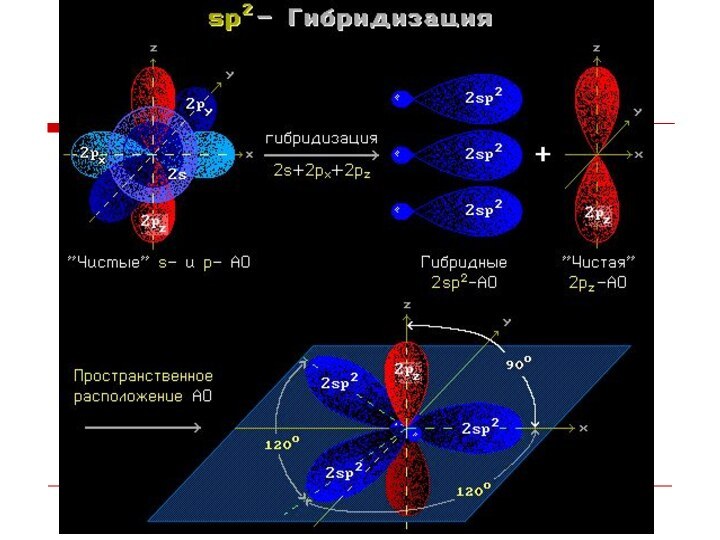
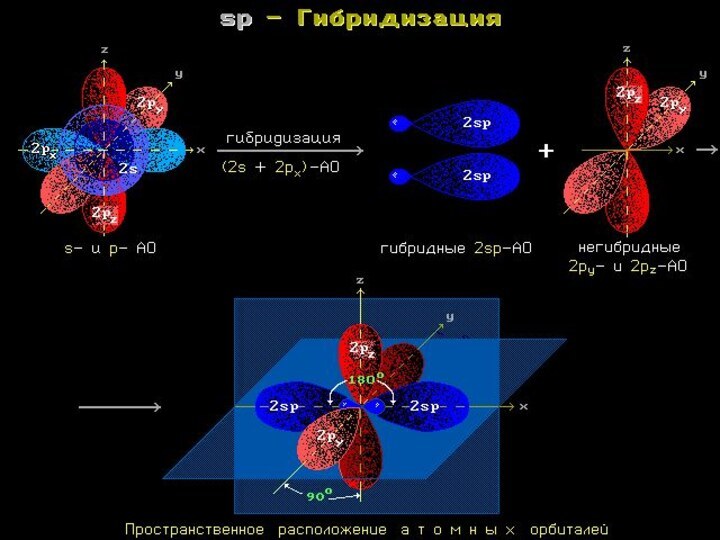
Гибридизация АО - это взаимодействие (смешение) разных по
типу, но близких по энергии атомных орбиталей данного атома
с образованием гибридных орбиталей одинаковой формы и энергии.
Такая связь прочнее связи, образованной электронами негибридных АО, за счет более эффективного перекрывания.
Слайд 14
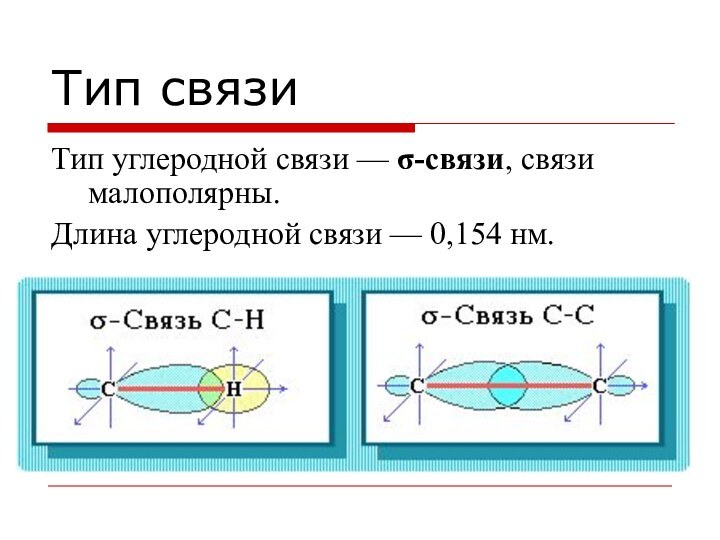
Тип связи
Тип углеродной связи — σ-связи, связи малополярны.
Длина
углеродной связи — 0,154 нм.
Слайд 15
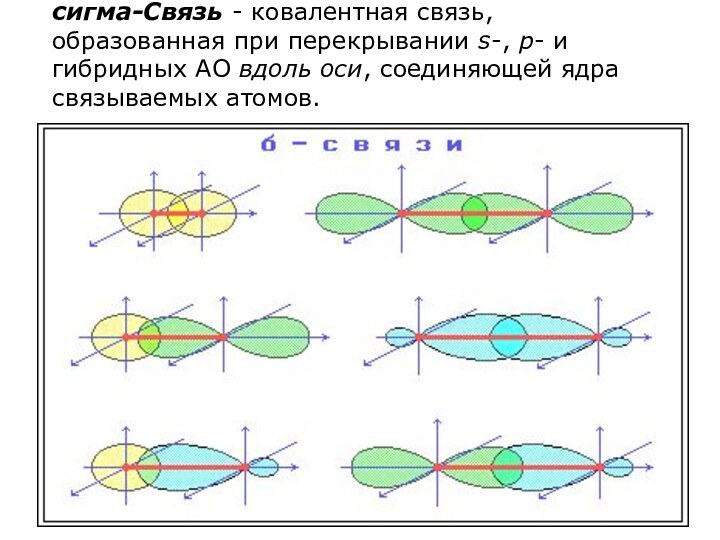
сигма-Связь - ковалентная связь, образованная при перекрывании s-,
p- и гибридных АО вдоль оси, соединяющей ядра связываемых
атомов.
Слайд 16
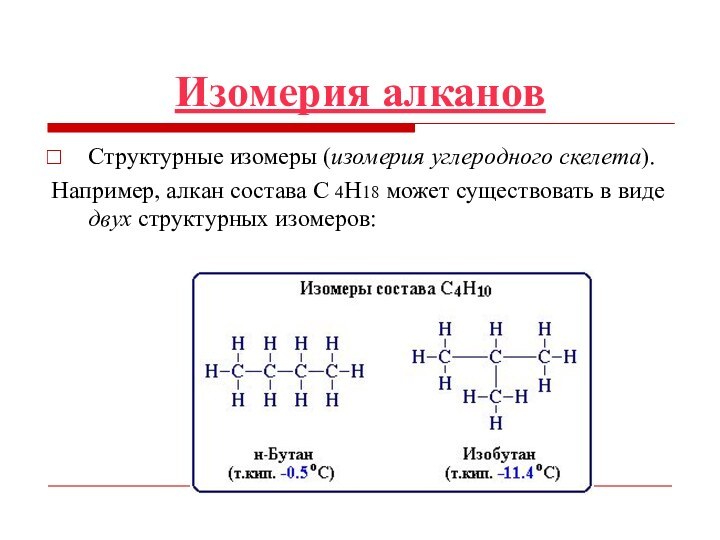
Изомерия алканов
Структурные изомеры (изомерия углеродного скелета).
Например, алкан состава
C 4H18 может существовать в виде двух структурных изомеров:
Слайд 17
Получение алканов
В промышленности:
извлекают из природного газа, нефти;
синтез из
простых веществ (проходит при повышенной температуре и давлении. Катализатор —
Ni) :
t
C + 2H₂ → CH₄
3) Синтез Фишера — Тропша
CO + H₂→ CH₄↑ + H₂O
Слайд 18
Получение алканов
2. Гидрирование непредельных углеводородов
Из алкенов
CnH2n
+ H2→ CnH2n+2
Из алкинов
CnH2n-2 + 2H2 →
CnH2n+2
Катализатором реакции являются соединения никеляКатализатором реакции являются соединения никеля, платиныКатализатором реакции являются соединения никеля, платины или палладия
Слайд 19
Получение алканов
В лаборатории:
1) Метан получают гидролизом карбида алюминия:
Al₄C₃
+12H₂O→ 4Al(OH)₃↓+3CH₄↑
Слайд 20
Получение алканов
В лаборатории:
2) реакция Вюрца:
t
CH₃Cl + 2Na + ClCH₃ →C₂H₆ + + 2NaCl
Реакция идёт в ТГФ при температуре 80 °C. При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`)
Слайд 21
Химические свойства алканов
Так как все связи насыщены до
предела, для алканов характерны реакции
Разложение (крекинг)
C8H18 t
C4H10 + C4H8
Отщепление (дегидрирование – отщепление водорода)
С2Н6 t C2H4 + H2
Горение 2С2Н6 + 5O2 = 4CO2 + 6H2O
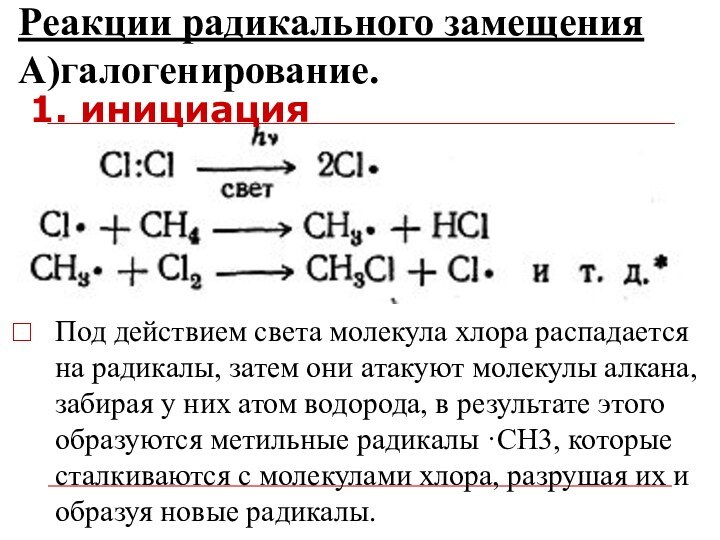
Замещение СН4 + Сl2 hv CH3Cl + HCl
Слайд 22
Под действием света молекула хлора распадается на радикалы,
затем они атакуют молекулы алкана, забирая у них атом
водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Реакции радикального замещения А)галогенирование.
1. инициация
Слайд 23
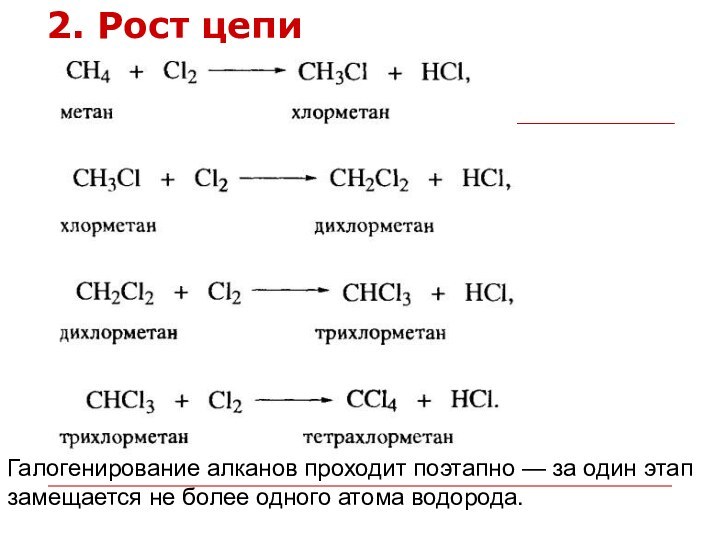
Галогенирование алканов проходит поэтапно — за один этап замещается
не более одного атома водорода.
2. Рост цепи
Слайд 25
Общая схема радикального замещения
Слайд 26
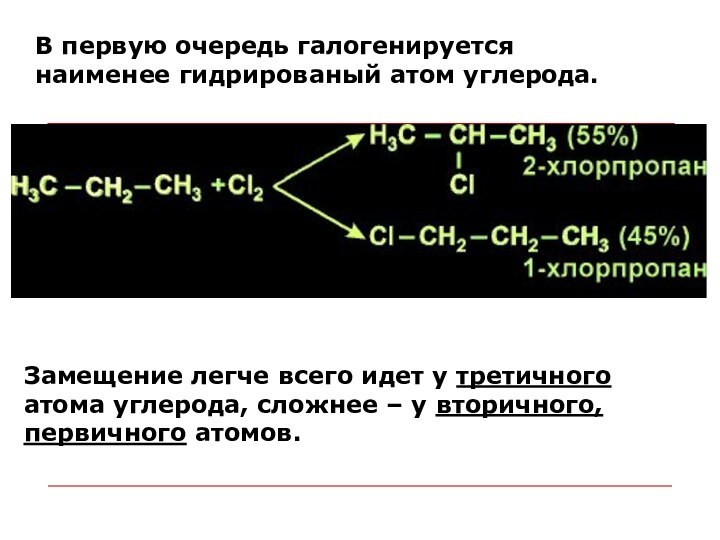
Замещение легче всего идет у третичного атома углерода,
сложнее – у вторичного, первичного атомов.
В первую очередь галогенируется
наименее гидрированый атом углерода.
Слайд 27
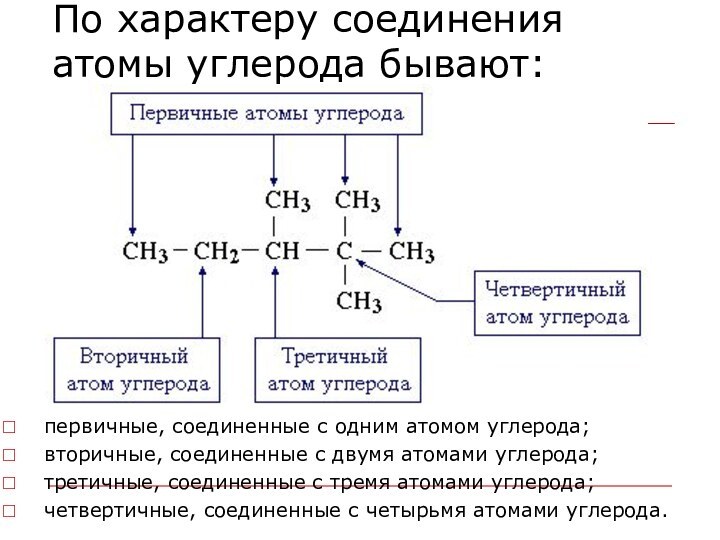
По характеру соединения атомы углерода бывают:
первичные, соединенные с
одним атомом углерода;
вторичные, соединенные с двумя атомами углерода;
третичные, соединенные
с тремя атомами углерода;
четвертичные, соединенные с четырьмя атомами углерода.
Слайд 30
б) Нитрование (реакция Коновалова).
Алканы реагируют с 10 % раствором
HNO₃ или оксидом азота NO₂ в газовой фазе при
температуре 140 °C и небольшом давлении с образованием нитропроизводных.
RH + HNO₃ → RNO₂ + H₂O.
Слайд 31
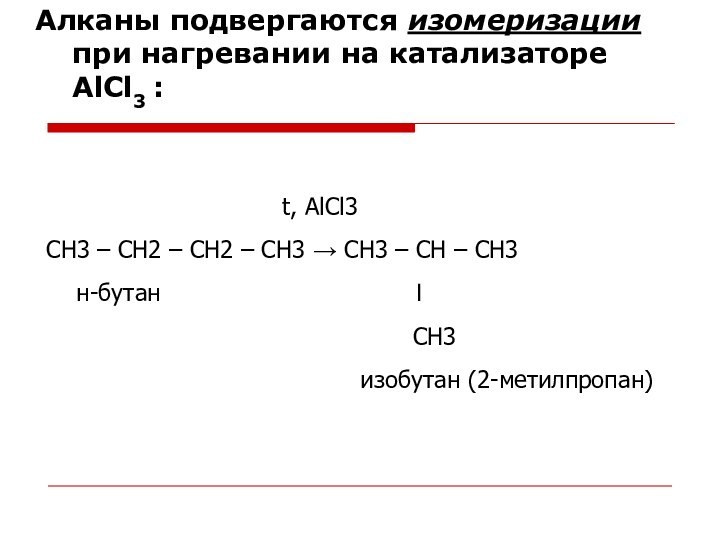
Алканы подвергаются изомеризации при нагревании на катализаторе AlCl3
:
t, AlCl3
CH3 – CH2 – CH2 – CH3 → CH3 – CH – CH3
н-бутан І
CH3
изобутан (2-метилпропан)
Слайд 32
Задание.
Построить и назвать изомеры для гексана.
Слайд 33
Алгоритм построения изомеров для алканов
По корню слова строят
углеродный скелет (гекса – 6 атомов углерода) С –
С – С – С – С – С это первый изомер.
Пускают разветвление с одной стороны (кроме последних атомов углерода)
С – С – С – С – С
С это второй изомер
Слайд 34
Пускают разветвление с другой стороны
С – С –
С – С
С С это
третий изомер
Можно сделать 2 разветвления у одного атома углерода кроме последних
С
С – С – С – С
С это четвёртый изомер
Слайд 35
Доставить атомы водорода с учётом, что углерод 4-хвалентен
СН3
– СН2 – СН2 – СН2 – СН2 –
СН3
СН3 – СН – СН2 – СН2 – СН3
СН3
СН3 – СН – СН – СН3
СН3 СН3
СН3
СН3 – С – СН2 – СН3
СН3
Слайд 36
Порядок построения названия
1.Выбрать в молекуле главную углеродную цепь.
Во-первых, она должна быть самой длинной. Во-вторых,
если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная.
Например, в молекуле есть 2 цепи с одинаковым числом (7) атомов С (выделены цветом):
В случае (а) цепь имеет 1 заместитель, а в (б) – 2. Поэтому следует выбрать вариант (б).
Слайд 37
Порядок построения названия
2. Пронумеровать атомы углерода в главной
цепи с той стороны, к которой ближе радикалы, или
старший заместитель, или кратная связь (в зависимости от класса веществ) Например:
Слайд 38
Порядок построения названия
3. Указать в префиксе (приставке) положение
(номер атома углерода) и название радикала (функциональной группы) в
алфавитном порядке.
Если есть несколько одинаковых заместителей, то для каждого из них через запятую записывается цифра (местоположение), а их количество указывается приставками ди-2, три-3, тетра-4, пента-5 и т.д. название радикала от количества атомов углерода в нём + суффикс ил
Например , 2,2-диметил или 2,3,3,5-тетраметил.
Слайд 39
Порядок построения названия
4. Записать корень, соответствующий числу атомов
углерода в главной цепи.
5. Если есть двойная связь, то
после корня поставить суффикс –ен с указанием положения связи в цепи
для тройной связи суффикс –ин.
Если кратных связей нет – суффикс -ан
Слайд 40
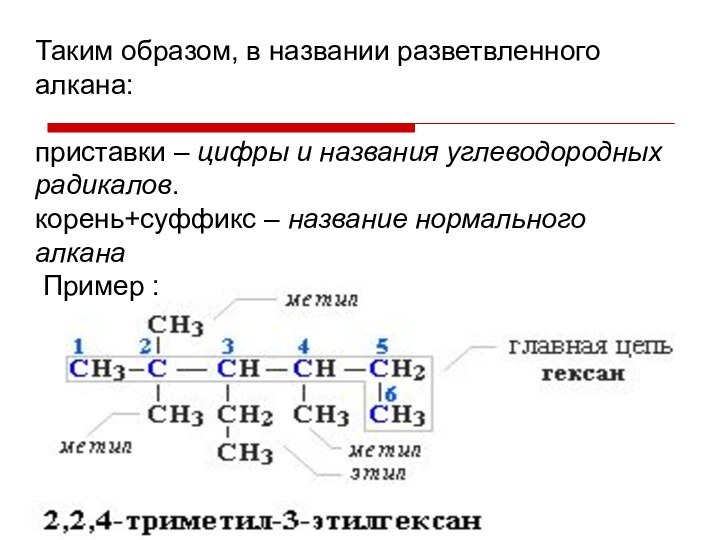
Таким образом, в названии разветвленного алкана:
приставки –
цифры и названия углеводородных радикалов.
корень+суффикс – название нормального
алкана
Пример :
Слайд 41
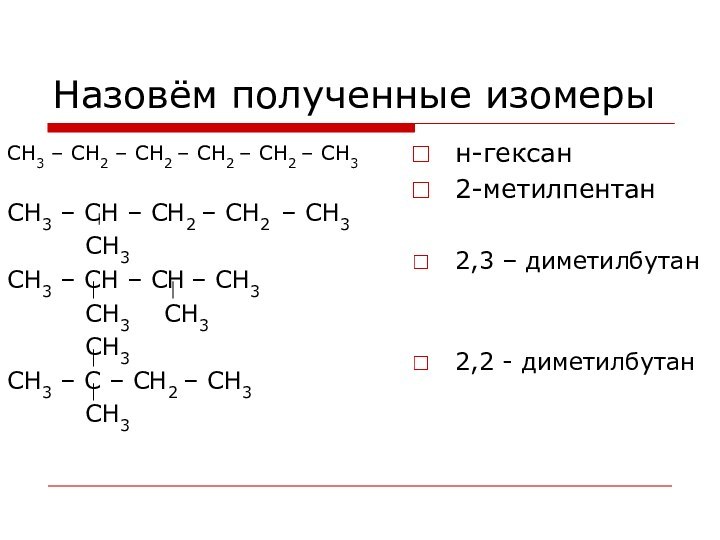
Назовём полученные изомеры
СН3 – СН2 – СН2 –
СН2 – СН2 – СН3
СН3 – СН – СН2
– СН2 – СН3
СН3
СН3 – СН – СН – СН3
СН3 СН3
СН3
СН3 – С – СН2 – СН3
СН3
н-гексан
2-метилпентан
2,3 – диметилбутан
2,2 - диметилбутан
Слайд 44
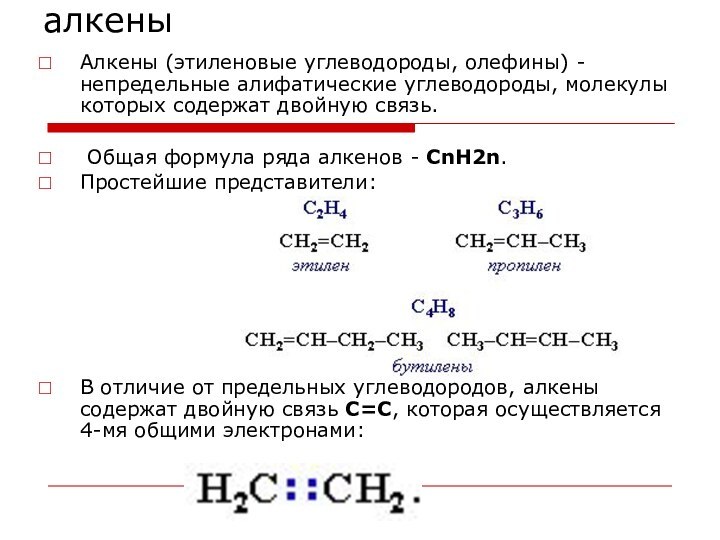
алкены
Алкены (этиленовые углеводороды, олефины) - непредельные алифатические углеводороды,
молекулы которых содержат двойную связь.
Общая формула ряда алкенов
- CnH2n.
Простейшие представители:
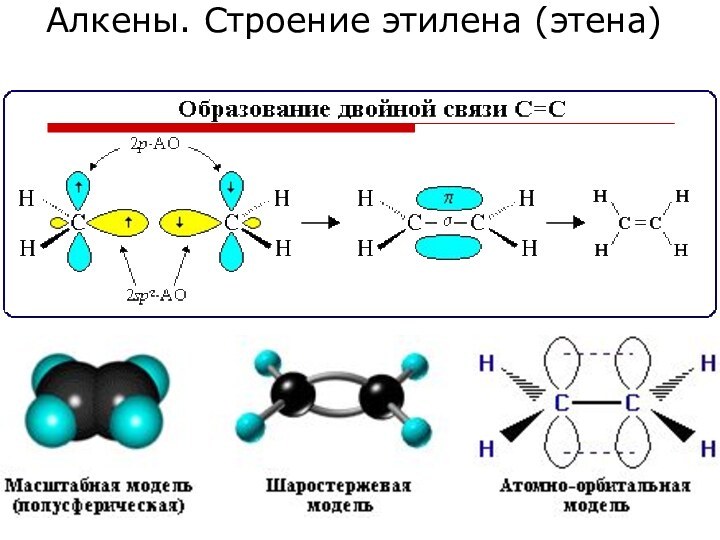
В отличие от предельных углеводородов, алкены содержат двойную связь С=С, которая осуществляется 4-мя общими электронами:
Слайд 45
Гомологический ряд алкенов
Этен
Пропен
Бутен
Пентен
Гексен
Гептен
C2H4
C3H6
C4H8
C5H10
C6H12
C7H14
Общая формула СnН2n
Слайд 46
Для простейших алкенов применяются также исторически сложившиеся названия:этилен
(этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п.
Слайд 48
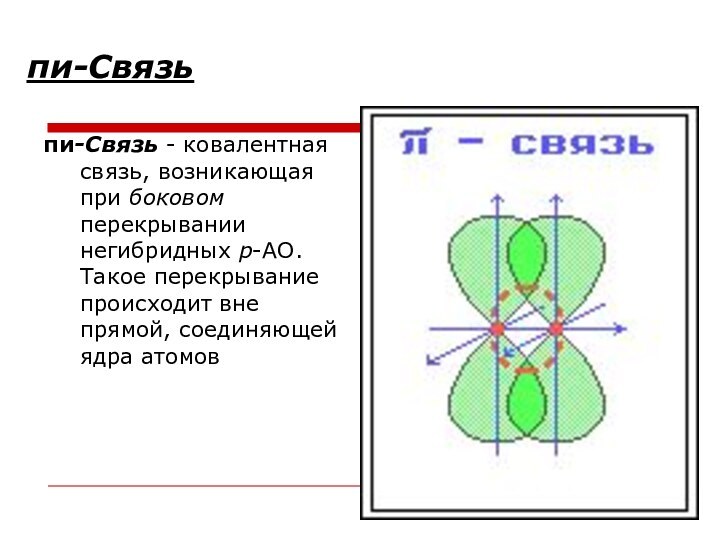
пи-Связь
пи-Связь - ковалентная связь, возникающая при боковом перекрывании
негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра
атомов
Слайд 49
Алкены. Строение этилена (этена)
Слайд 50
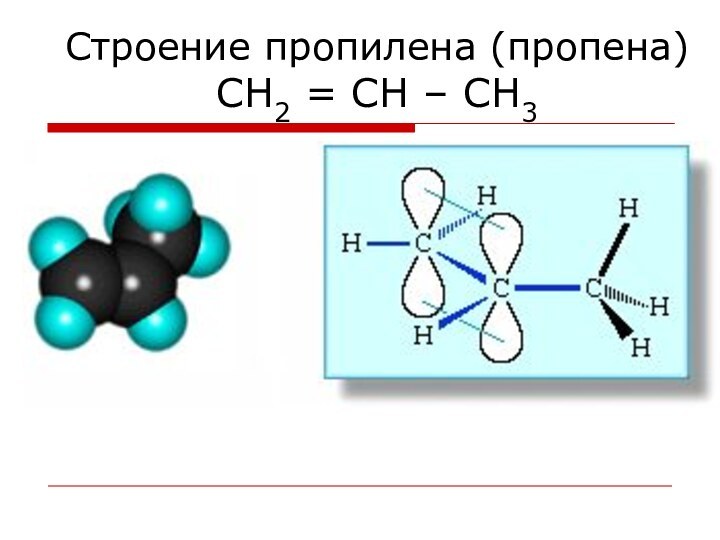
Строение пропилена (пропена)
СН2 = СН – СН3
Слайд 51
Номенклатура алкенов
Нумерацию углеродных атомов начинают с ближнего
к двойной связи конца цепи. Цифра, обозначающая положение двойной
связи, ставится обычно после суффикса –ен. Например:
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
Слайд 52
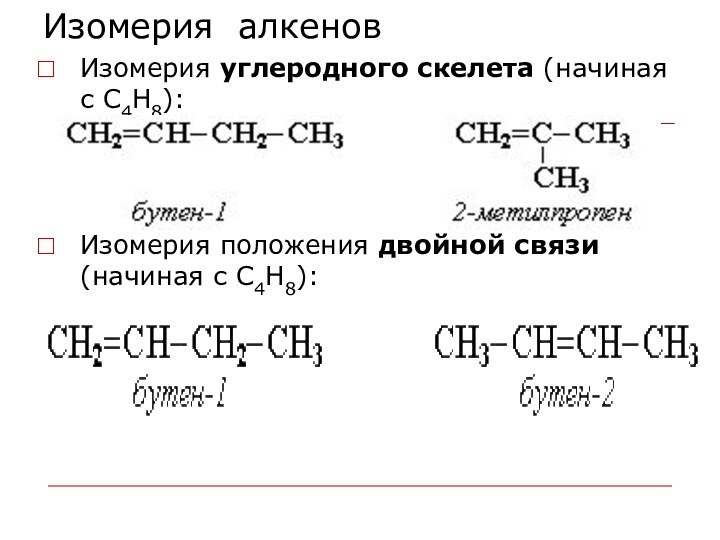
Изомерия алкенов
Для алкенов возможны два типа изомерии:
1-ый тип
– структурная изомерия:
углеродного скелета
положения двойной связи
Межклассовая
2-ой тип –
пространственная изомерия:
геометрическая
Слайд 53
Изомерия алкенов
Изомерия углеродного скелета (начиная с С4Н8):
Изомерия положения двойной связи (начиная с С4Н8):
Слайд 54
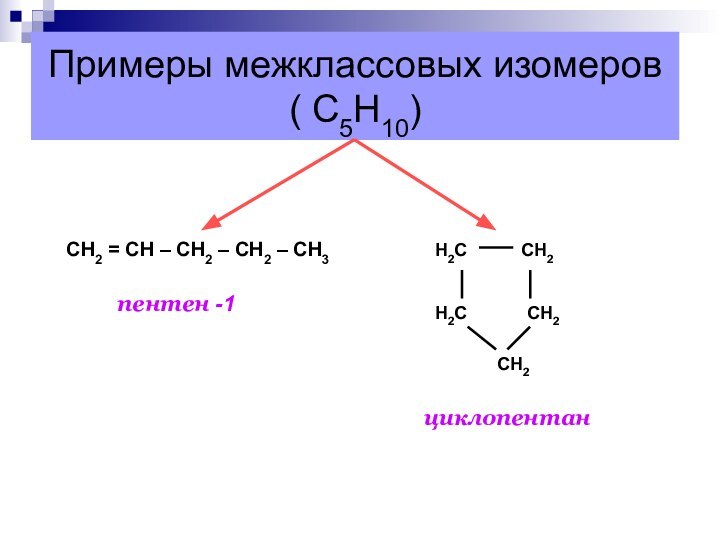
Примеры межклассовых изомеров
( С5Н10)
СН2 = СН –
СН2 – СН2 – СН3
пентен -1
циклопентан
Слайд 55
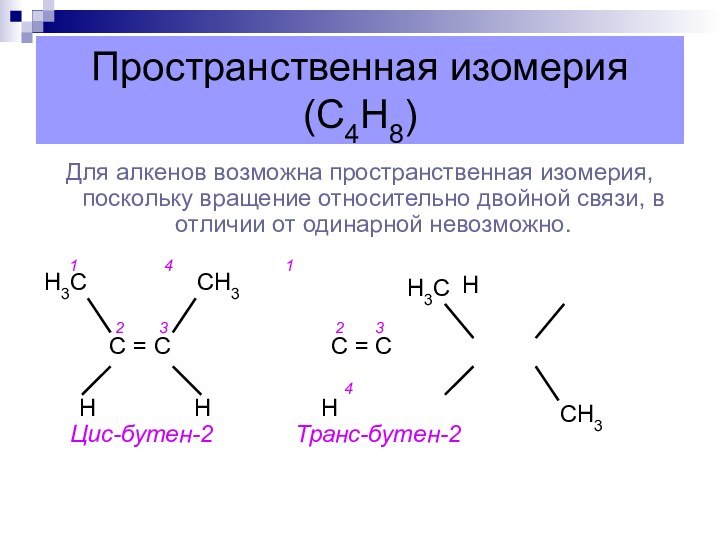
Пространственная изомерия (С4Н8)
Для алкенов возможна пространственная изомерия, поскольку
вращение относительно двойной связи, в отличии от одинарной невозможно.
1 4 1
Н
2 3 2 3
С = С С = С
4
Н Н Н Цис-бутен-2 Транс-бутен-2
Н3С
СН3
Н3С
СН3
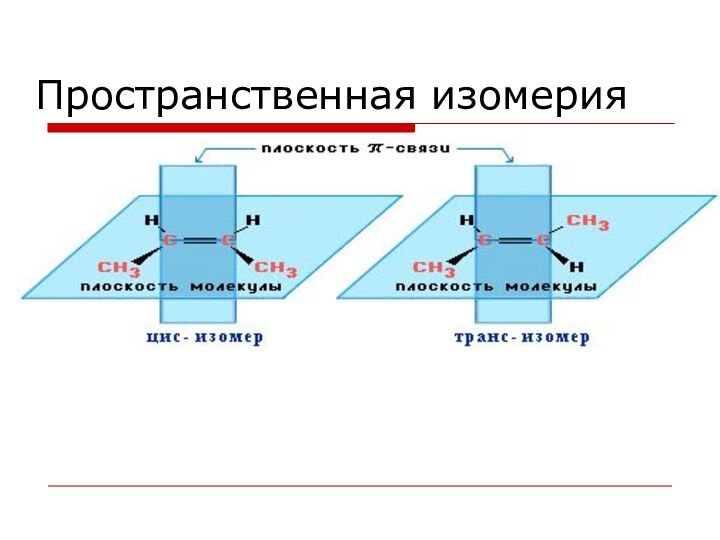
Слайд 57
Геометрические изомеры бутена
Цис-изомер
Транс-изомер
Слайд 58
Физические свойства алкенов
Алкены плохо растворимы в воде, но
хорошо растворяются в органических растворителях.
С2– С4 - газы
С5–
С16 - жидкости
С17… - твёрдые вещества
С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
Слайд 59
Химические свойства алкенов
Алкены более химически активные вещества, в
отличие от алканов, что обусловлено наличием двойной связи. Алкены
способны присоединять два одновалентных атома или радикала за счёт разрыва π-связи, как менее прочной.
Слайд 60
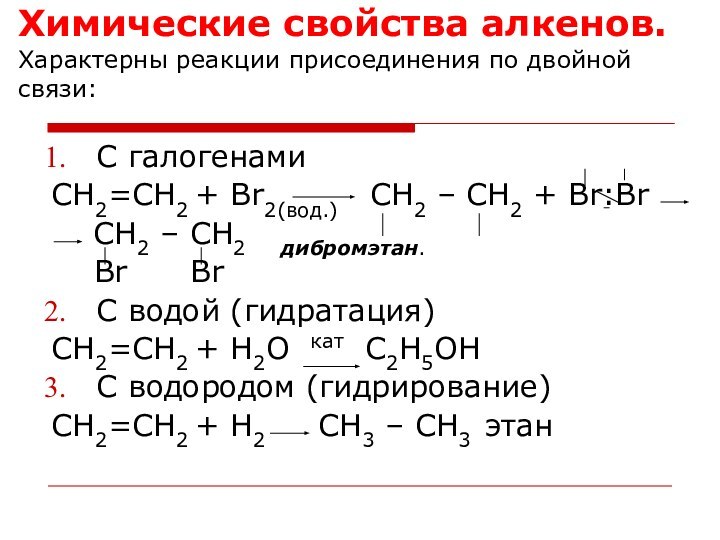
Химические свойства алкенов.
Характерны реакции присоединения по двойной связи:
С
галогенами
CH2=CH2 + Br2(вод.) СH2 – CH2 +
Br:Br
CH2 – CH2 дибромэтан.
Br Br
С водой (гидратация)
CH2=CH2 + Н2О кат С2Н5ОН
С водородом (гидрирование)
CH2=CH2 + Н2 CH3 – CH3 этан
Слайд 61
Гидрогалогенирование гомологов этилена
Правило В.В. Марковникова
Атом водорода присоединяется к
наиболее гидрированному атому углерода при двойной связи, а атом
галогена или гидроксогруппа – к наименее гидрированному.
Слайд 62
Реакция полимеризации
CH2=CH2 + CH2=CH2 + CH2=CH2 + …
-СH2
– CH2- + -СH2 – CH2- + -СH2–CH2-
-СH2
– CH2-СH2–CH2-СH2–CH2- …
Или: nCH2=CH2 (-СH2 – CH2- )n
этилен полиэтилен
Полимеризация – это процесс соединения одинаковых молекул в более крупные молекулы.
Слайд 63
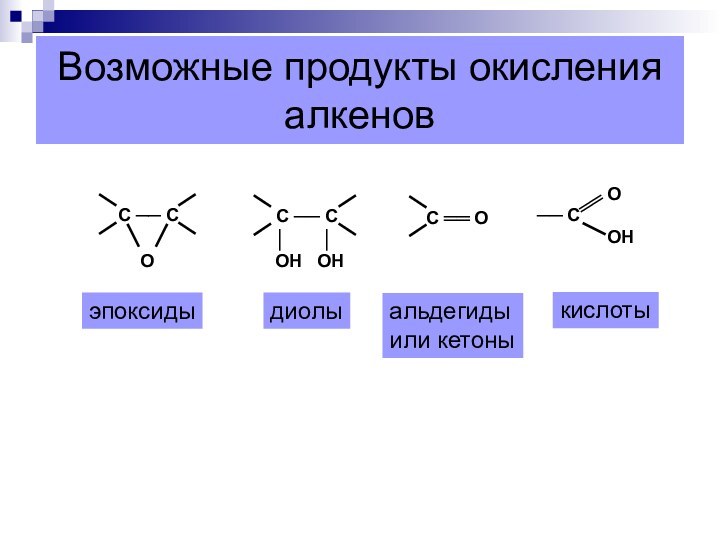
Возможные продукты окисления алкенов
эпоксиды
диолы
альдегиды
или кетоны
кислоты
Слайд 64
Реакции окисления
Реакция Вагнера. (Мягкое окисление раствором перманганата калия).
3СН2
= СН2 + 2КМnО4 + 4Н2О
3СН2 - СН2 + 2МnО2 + 2КОН
ОН ОН
Или
С2Н4 + (О) + Н2О С2Н4(ОН)2
этандиол
этен
Слайд 65
Горение алкенов
Алкены горят красноватым светящимся пламенем, в
то время как пламя предельных углеводородов голубое.
Горение этилена
https://www.youtube.com/watch?v=WXXu1gAEtkI
Слайд 66
Лабораторные способы получения алкенов
При получении алкенов необходимо учитывать
правило А.М. Зайцева: при отщеплении галогеноводорода или воды от
вторичных и третичных галогеналканов или спиртов атом водорода отщепляется от наименее гидрированного атома углерода.
Дегидрогалогенирование галогеналканов.
Н3С ─ СН2─ СНСl ─ СН3 + КОН →
2-хлорбутан
Н3С ─ СН ═ СН ─ СН3 + КСl + Н2О
бутен-2
Условия реакции: нагревание.
Слайд 67
Лабораторные способы получения алкенов
Дегидратация спиртов.
Н3С ─ СН2 ─
ОН → Н2С ═ СН2 + Н2О
этанол этен
Условия реакции: катализатор – Н2SO4(конц.), t = 180ºС.
Дегалогенирование дигалогеналканов.
Н3С ─ СНCl ─ СН2Сl + Мg → Н3С─СН ═ СН2 + MgCl2
1,2-дихлорпрпан пропен
Слайд 68
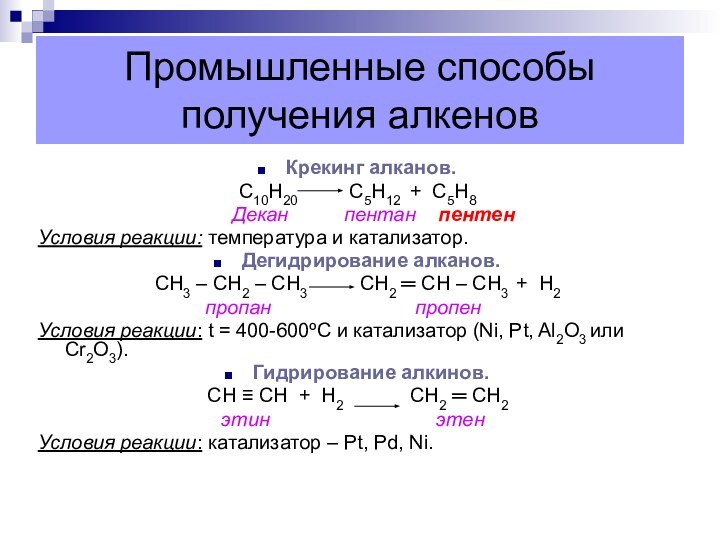
Промышленные способы получения алкенов
Крекинг алканов.
С10Н20
С5Н12 + С5Н8
Декан пентан пентен
Условия реакции: температура и катализатор.
Дегидрирование алканов.
СН3 – СН2 – СН3 СН2 ═ СН – СН3 + Н2
пропан пропен
Условия реакции: t = 400-600ºС и катализатор (Ni, Pt, Al2O3 или Cr2O3).
Гидрирование алкинов.
CН ≡ СН + Н2 СН2 ═ СН2
этин этен
Условия реакции: катализатор – Pt, Pd, Ni.
Слайд 70
Алкины
Алкины (Производные ацетилена) – непредельные углеводороды, молекулы которых
содержат одну тройную связь.
Общая формула алкинов СnH2n-2.
Простейшие представители:
Слайд 71
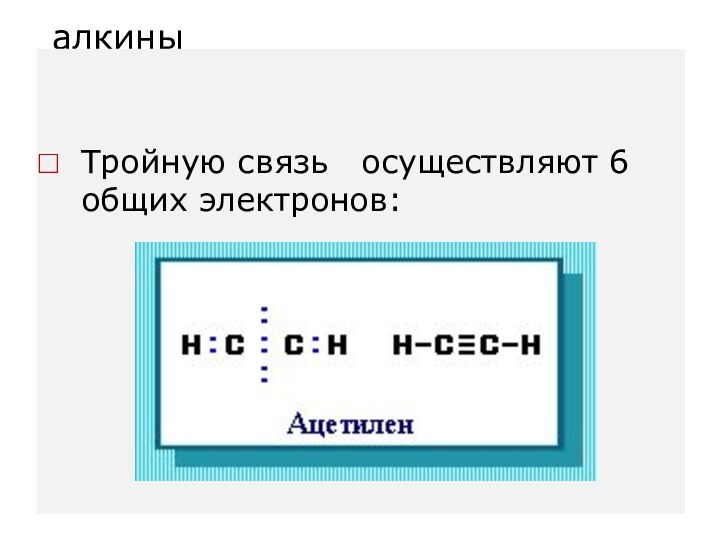
алкины
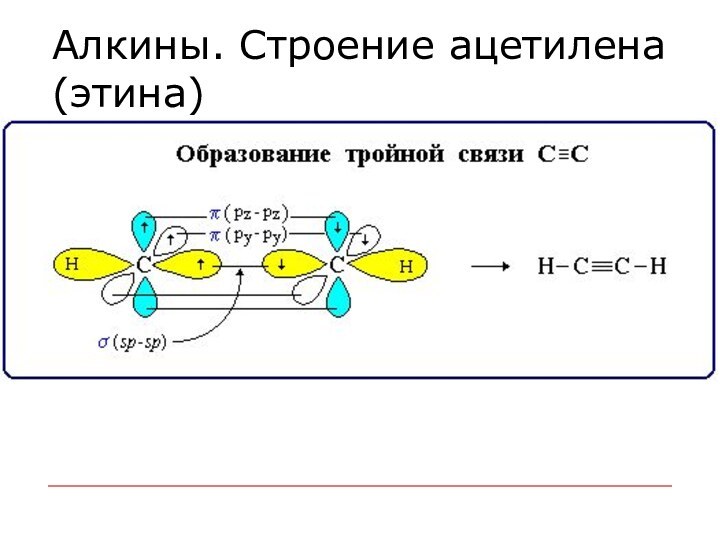
Тройную связь осуществляют 6 общих электронов:
Слайд 73
Алкины. Строение ацетилена (этина)
Слайд 74
Номенклатура алкинов
названия ацетиленовых углеводородов соответствуют названиям алканов
суффикс
–ан меняют на –ин:
Главная цепь должна включать тройную
связь (она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин.
Например:
Слайд 75
Для простейших алкенов применяются также исторически сложившиеся названия:
ацетилен (этин),
аллилен (пропин),
кротонилен (бутин-1),
валерилен (пентин-1).
В номенклатуре наиболее
часто используются следующие одновалентные радикалы алкинов:
Слайд 76
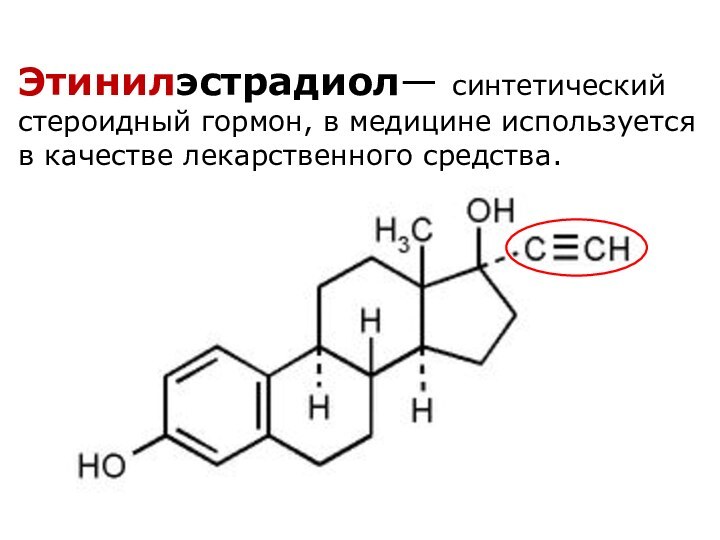
Этинилэстрадиол— синтетический стероидный гормон, в медицине используется в
качестве лекарственного средства.
Слайд 78
Из карбида кальция
Способы получения
Слайд 79
Дегидрогалогенирование
Способы получения
Слайд 80
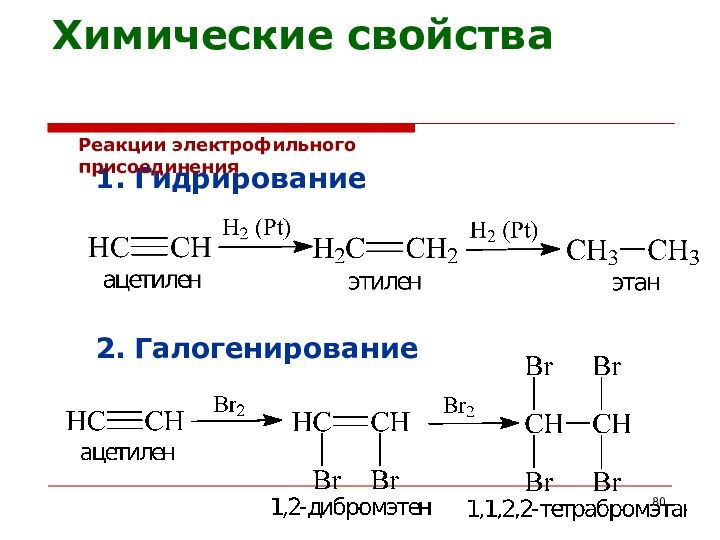
1. Гидрирование
Реакции электрофильного присоединения
2. Галогенирование
Химические свойства
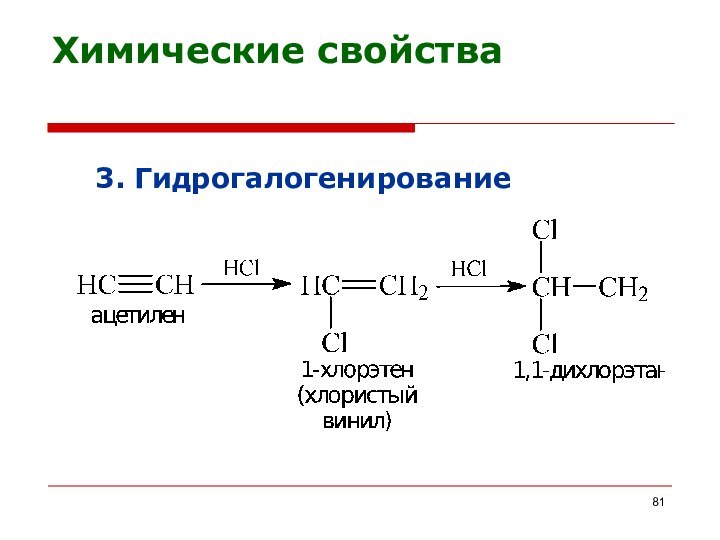
Слайд 81
3. Гидрогалогенирование
Химические свойства
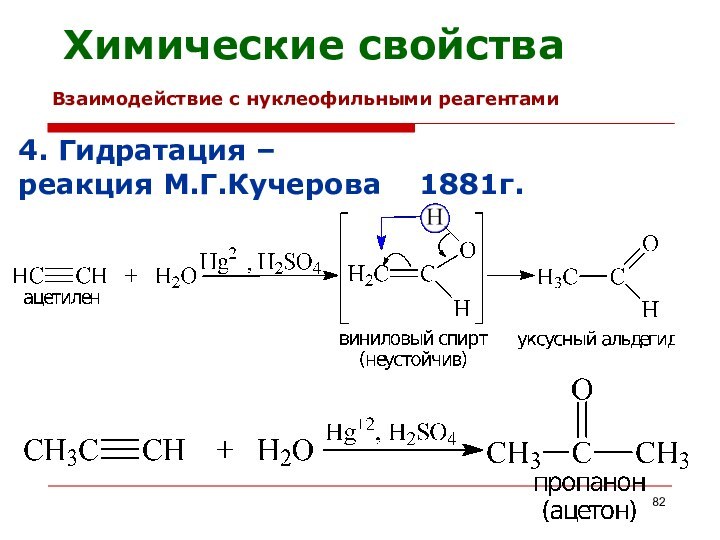
Слайд 82
Химические свойства
4. Гидратация –
реакция М.Г.Кучерова 1881г.
Взаимодействие с нуклеофильными реагентами
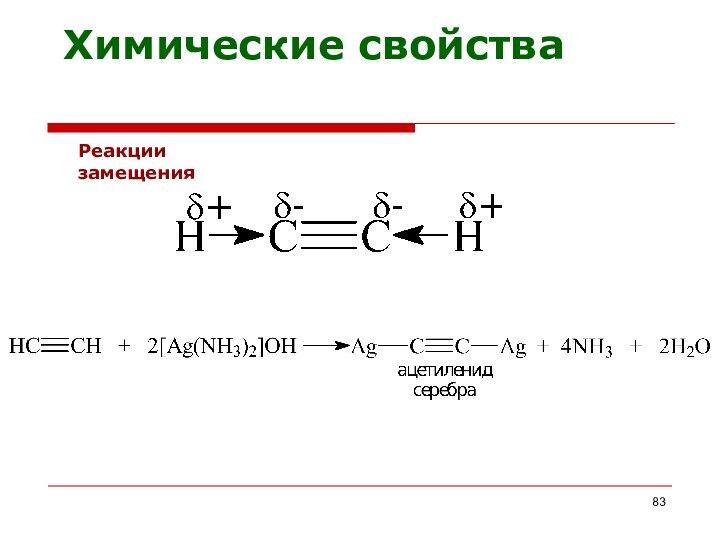
Слайд 83
Реакции замещения
Химические свойства
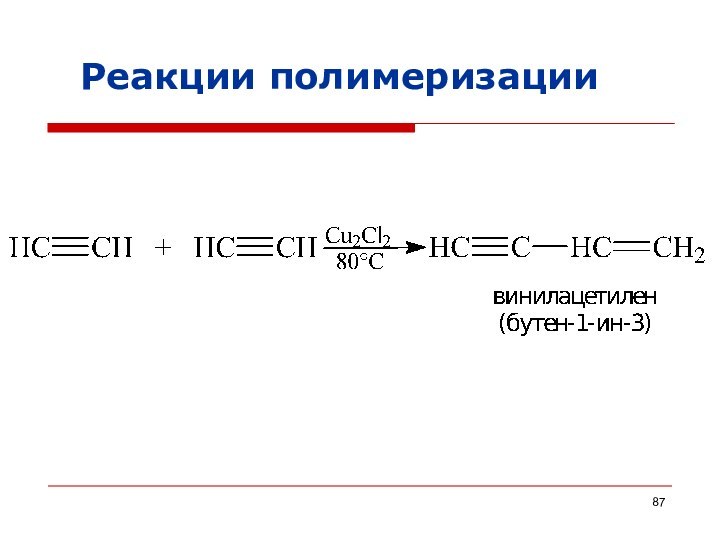
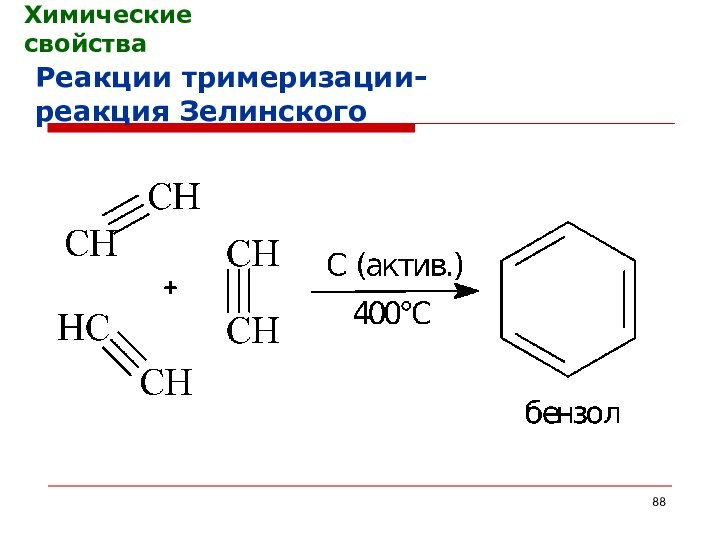
Слайд 88
Химические свойства
Реакции тримеризации-
реакция Зелинского
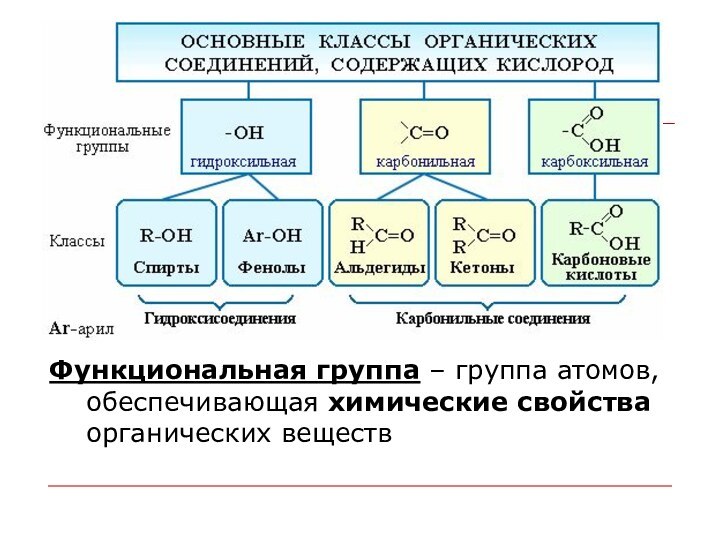
Слайд 91
Функциональная группа – группа атомов, обеспечивающая химические свойства
органических веществ
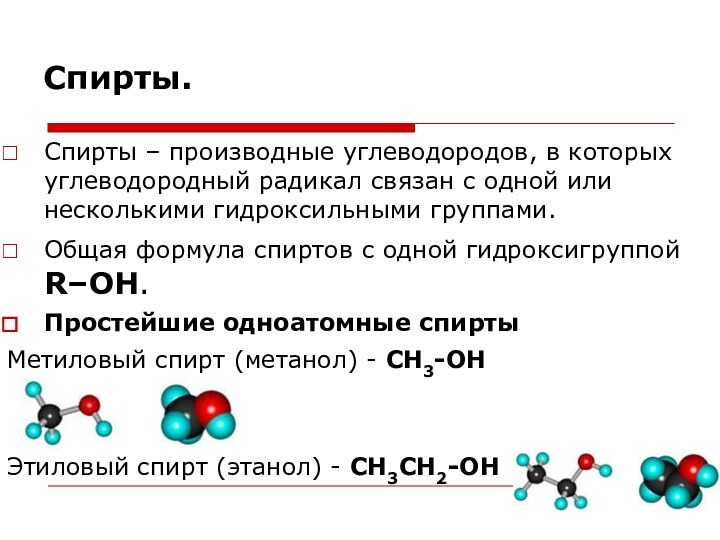
Слайд 92
Спирты.
Спирты – производные углеводородов, в которых углеводородный радикал
связан с одной или несколькими гидроксильными группами.
Общая формула спиртов
с одной гидроксигруппой R–OH.
Простейшие одноатомные спирты
Метиловый спирт (метанол) - CH3-OH
Этиловый спирт (этанол) - CH3CH2-OH
Слайд 93
Многоатомные спирты
Этиленгликоль – двухатомный спирт СН2 – СН2
ОН
ОН
Как его можно получить?
Бесцветная густая жидкость тяжелее воды, имеет сладкий вкус. t кип - +197оС, замерзания – (-13оС)
Применяют в качестве антифриза – незамерзающей охлаждающей жидкости.
Слайд 94
Многоатомные спирты
Глицерин – трёхатомный спирт
СН2 – СН –
СН2
ОН ОН ОН
Густая сиропообразная бесцветная жидкость сладкого
вкуса. Хорошо растворяется в воде.
Применяют при выделке кожи и отдельных тканей(предохраняет предметы от высыхания), в парфюмерии и медицине используют только водные растворы, так как безводный глицерин очень гигроскопичен и поэтому обезвоживает кожу.
Слайд 95
Химические свойства спиртов обусловлены наличием функциональной группы -
ОН
Взаимодействует:
С кислотами
С активными металлами
Горит с выделением углекислого газа и
воды (составьте уравнение реакции)
Частично окисляется О
СН3–СН2–ОН + О СН3–С +Н2О
Н
Слайд 96
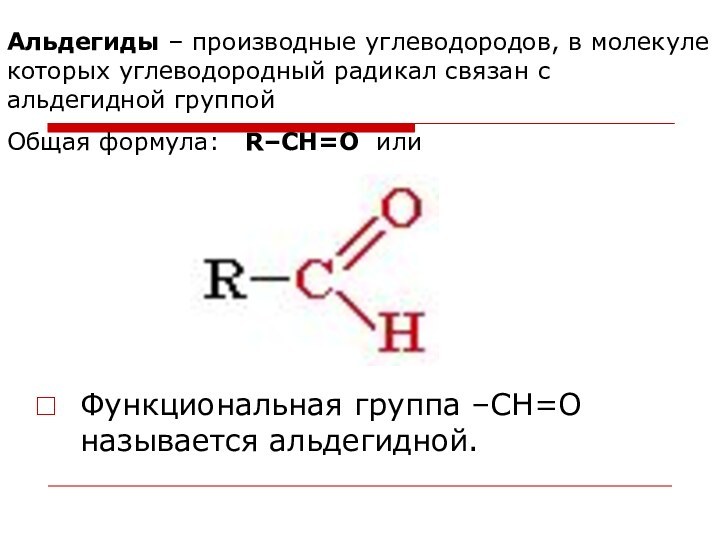
Альдегиды – производные углеводородов, в молекуле которых углеводородный
радикал связан с альдегидной группой
Общая формула: R–CН=O или
Функциональная группа –СН=О
называется альдегидной.
Слайд 97
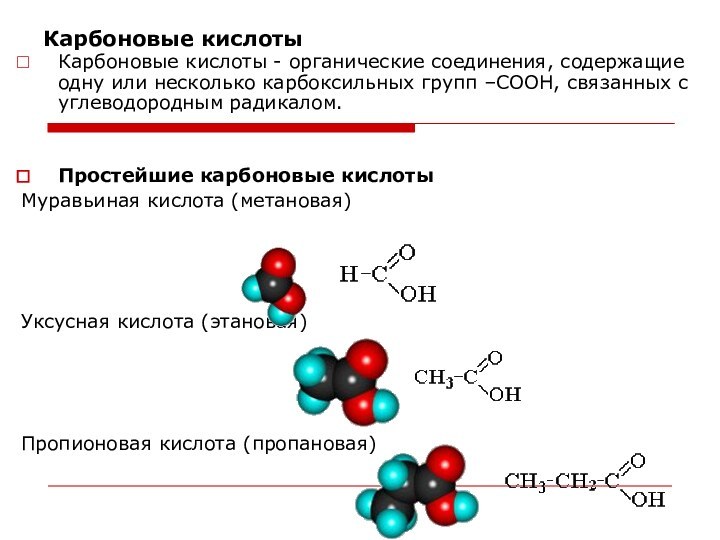
Карбоновые кислоты
Карбоновые кислоты - органические соединения, содержащие одну
или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Простейшие карбоновые кислоты
Муравьиная кислота (метановая)
Уксусная кислота (этановая)
Пропионовая кислота (пропановая)
Слайд 98
Систематические названия кислот даются по названию соответствующего углеводорода
с добавлением суффикса -овая и слова кислота.
HCOOH метановая муравьиная
CH3COOH
этановая уксусная
C2H5COOH пропановая пропионовая
C3H7COOH бутановая масляная
C4H9COOH пентановая валерьяновая
C5H11COOH гексановая капроновая
C15H31COOH пентадекановая пальмитиновая
C17H35COOH гептадекановая стеариновая
Общая формула предельных одноосновных кислот: СnH2n+1COOH
Слайд 99
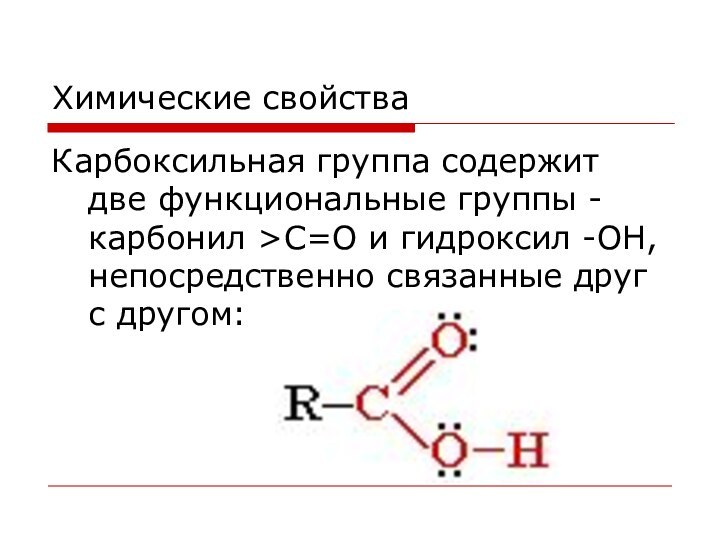
Химические свойства
Карбоксильная группа содержит две функциональные группы -
карбонил >С=О и гидроксил -OH, непосредственно связанные друг с
другом:
Слайд 100
Характерны реакции с:
Со спиртами (реакция этерификации)
Продуктом является сложный
эфир
Составьте уравнение реакции взаимодействия уксусной кислоты и этилового спирта.
С
металлами Составьте уравнение реакции взаимодействия уксусной кислоты и натрия, назовите продукты реакции (соли уксусной кислоты называются ацетатами)
Слайд 101
С солями более слабых карбоновых кислот
Составьте уравнение
реакции взаимодействия уксусной кислоты и карбоната натрия, назовите продукты
реакции
Получить одноосновную карбоновую кислоту можно окислением альдегида
См. учебник стр. 217
Слайд 102
Жиры.
Жиры - сложные эфиры глицерина и высших одноатомных
карбоновых кислот.
В состав природных триглицеридов входят остатки насыщенных
кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH) и ненасыщенных (олеиновой C17H33COOH, линолевой C17H29COOH).
Жиры содержатся во всех растениях и животных.
Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение - рыбий жир). Жиры состоят главным образом из триглицеридов предельных кислот.
Растительные жиры - масла (подсолнечное, соевое, хлопковое и др.) - жидкости (исключение - кокосовое масло). В состав триглицеридов масел входят остатки непредельных кислот.
Слайд 103
Жидкие жиры превращают в твердые путем реакции гидрирования.
При этом водород присоединяется по двойной связи, содержащейся в
углеводородном радикале молекул масел.
Продукт гидрогенизации масел - твердый жир (искусственное сало, саломас).
Маргарин - пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Продуктами щелочного гидролиза жиров являются мыла - соли высших карбоновых кислот и щелочных металлов. (Омыление жиров)
Слайд 104
Углеводы (сахара) - органические вещества, состав которых выражается
формулой Cx(H2O)y, где x и y > 3.
В
природе образуются в результате фотосинтеза.
НЕКОТОРЫЕ ВАЖНЕЙШИЕ УГЛЕВОДЫ
Простые (негидролизующиеся) - Моносахариды:
глюкоза С6Н12О6
фруктоза С6Н12О6
рибоза С5Н10О5
Сложные (гидролизующиеся) - Олигосахариды: сахароза (дисахарид) С12Н22О11
Полисахариды: крахмал (С6Н10О5)n, целлюлоза (С6Н10О5)n
Слайд 105
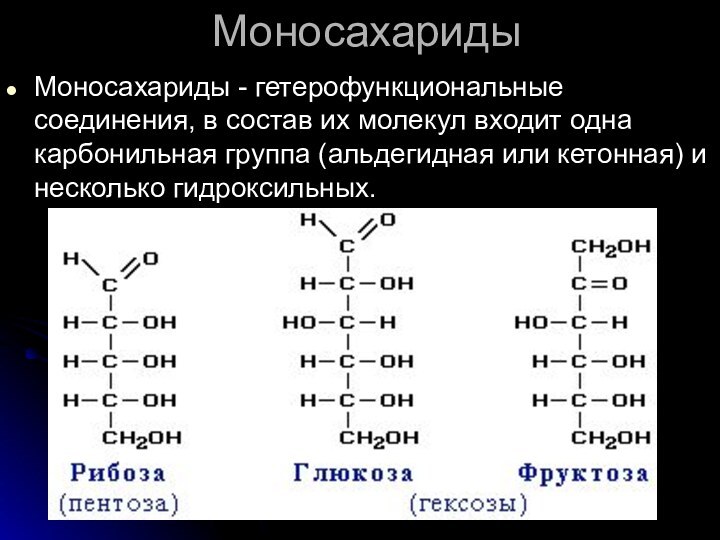
Моносахариды
Моносахариды - гетерофункциональные соединения, в состав их
молекул входит одна карбонильная группа (альдегидная или кетонная) и
несколько гидроксильных.
Слайд 106
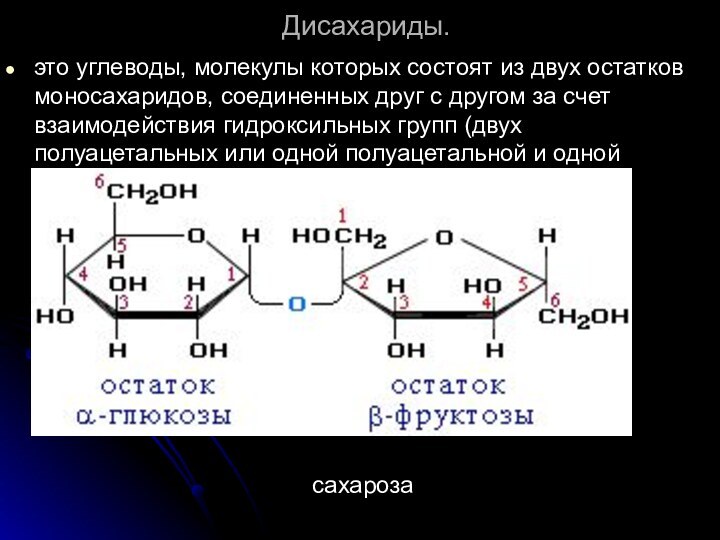
Дисахариды.
это углеводы, молекулы которых состоят из двух остатков
моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных
групп (двух полуацетальных или одной полуацетальной и одной спиртовой).
сахароза
Слайд 107
Крахмал
В его состав входят:
амилоза (внутренняя часть крахмального
зерна) - 10-20%
амилопектин (оболочка крахмального зерна) - 80-90%
Макромолекула
амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 - 6 млн. Подобно амилопектину построен гликоген (животный крахмал).
Слайд 108
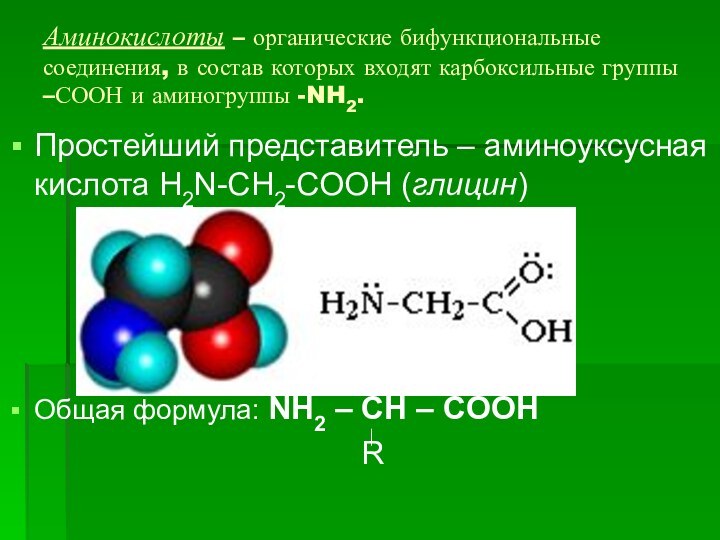
Аминокислоты – органические бифункциональные соединения, в состав которых
входят карбоксильные группы –СООН и аминогруппы -NH2.
Простейший представитель –
аминоуксусная кислота H2N-CH2-COOH (глицин)
Общая формула: NH2 – CH – COOH
R
Слайд 109
Физические свойства
Аминокислоты – твердые кристаллические вещества с
высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде,
водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Слайд 110
Химические свойства
Аминокислоты проявляют свойства оснований за счет аминогруппы
и свойства кислот за счет карбоксильной группы, т.е. являются
амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl Cl- [H3N–CH2–COOH]+
Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2–COOH + NaOH H2N–CH2–COO- Na+ + H2O
б) сложные эфиры
Слайд 111
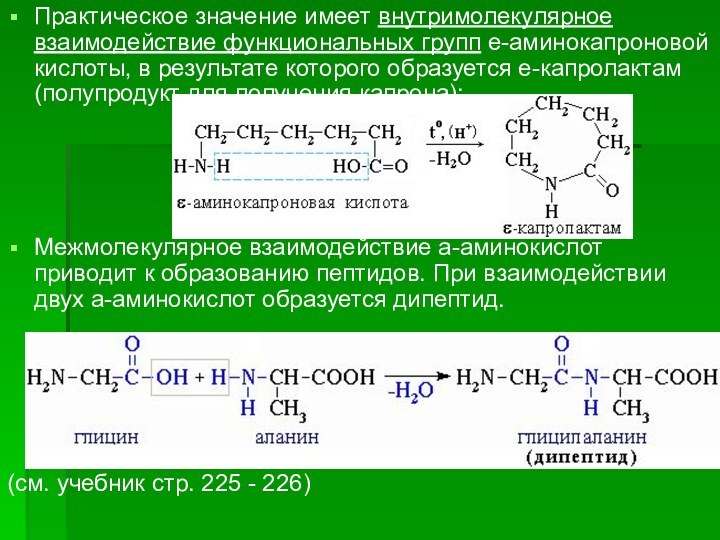
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп e-аминокапроновой
кислоты, в результате которого образуется e-капролактам (полупродукт для получения
капрона):
Межмолекулярное взаимодействие a-аминокислот приводит к образованию пептидов. При взаимодействии двух a-аминокислот образуется дипептид.
(см. учебник стр. 225 - 226)
Слайд 113
Белки (полипептиды) - биополимеры, построенные из остатков a-аминокислот,
соединённых пептидными (амидными) связями.
Функции белков в природе :
каталитические
(ферменты);
регуляторные (гормоны);
структурные (кератин шерсти, фиброин шелка, коллаген);
двигательные (актин, миозин);
транспортные (гемоглобин);
запасные (казеин, яичный альбумин);
защитные (иммуноглобулины) и т.д.
Слайд 114
Уровни структурной организации белков.
Слайд 115
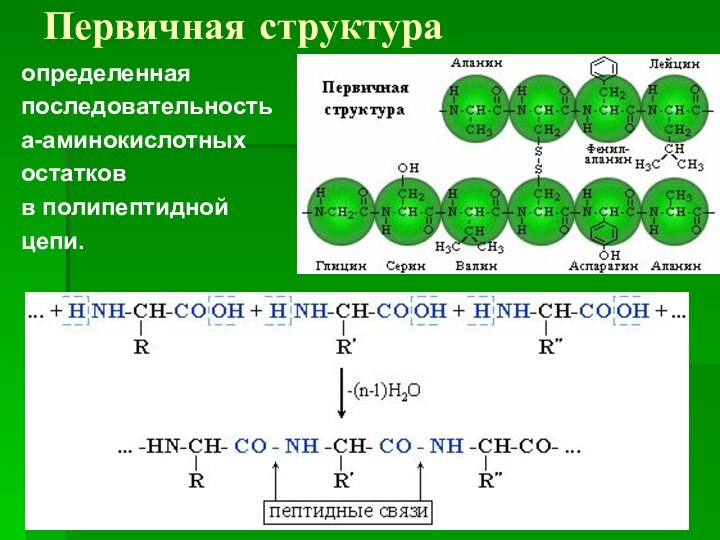
Первичная структура
определенная
последовательность
a-аминокислотных
остатков
в полипептидной
цепи.
Слайд 116
Вторичная структура
конформация полипептидной
цепи, закрепленная
множеством водородных
связей
между группами
N-H и С=О.
Одна из моделей вторичной
структуры - a-спираль.
Слайд 117
Третичная структура -
форма закрученной
спирали в пространстве,
образованная главным
образом за счет
дисульфидных мостиков
-S-S-, водородных
связей,
гидрофобных и ионных
взаимодействий.
Слайд 118
Четвертичная структура -
агрегаты нескольких
белковых макромолекул
(белковые комплексы),
образованные
за счет
взаимодействия разных
полипептидных цепей.