Слайд 2
Как же химики судят о том,
является ли данное вещество кислотой?
Растворы всех кислот на вкус
кислые.
Но ни один химик не будет распознавать кислоты на вкус.
Слайд 3
1)Что такое индикаторы?
2)Какие индикаторы вы знаете?
3)
Как индикаторы меняют цвет в щелочной среде?
Слайд 4
Изменение цвета индикаторов в щелочной среде
Слайд 5
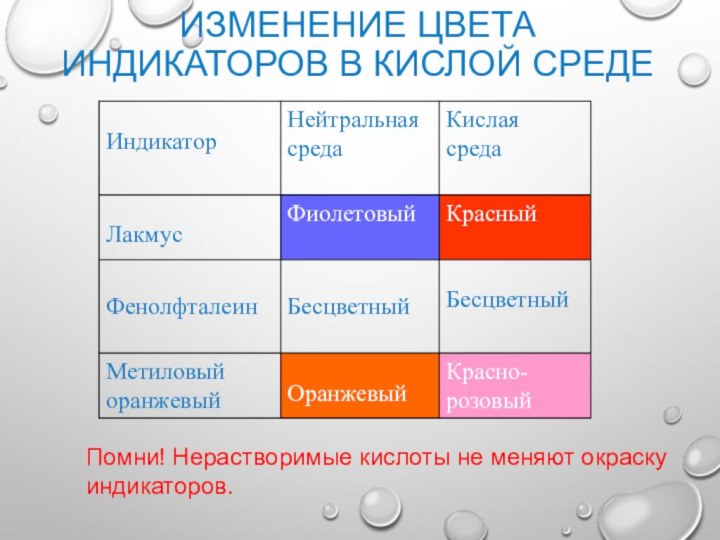
Изменение цвета индикаторов в кислой среде
Помни! Нерастворимые кислоты
не меняют окраску индикаторов.
Слайд 7
Кислоты – это сложные вещества, молекулы, которых состоят
из атомов водорода и кислотных остатков
Слайд 8
По числу атомов водорода
Классификация кислот
Слайд 9
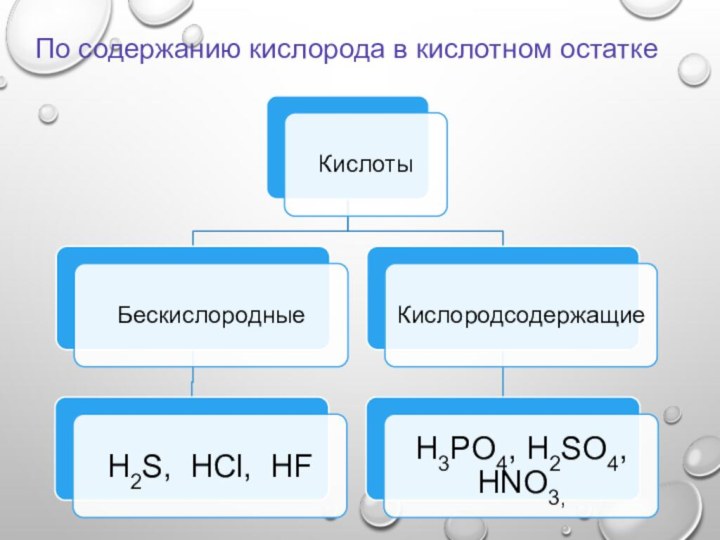
По содержанию кислорода в кислотном остатке
Слайд 13
Химический диктант
ВАРИАНТ 1
ВАРИАНТ 2
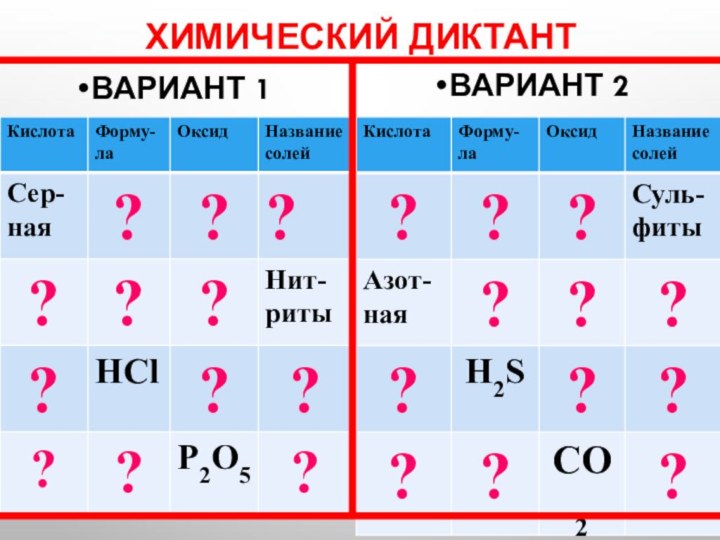
Серная
Азотная
Соляная
Угольная
Азотистая
Сернистая
Кремниевая
Сероводородная
Фосфорная
Угольная
Цвет лакмуса в кислоте
Цвет
фенолфталеина в щелочах
Цвет лакмуса в щелочах
Цвет метилоранжа в щелочах
Слайд 15
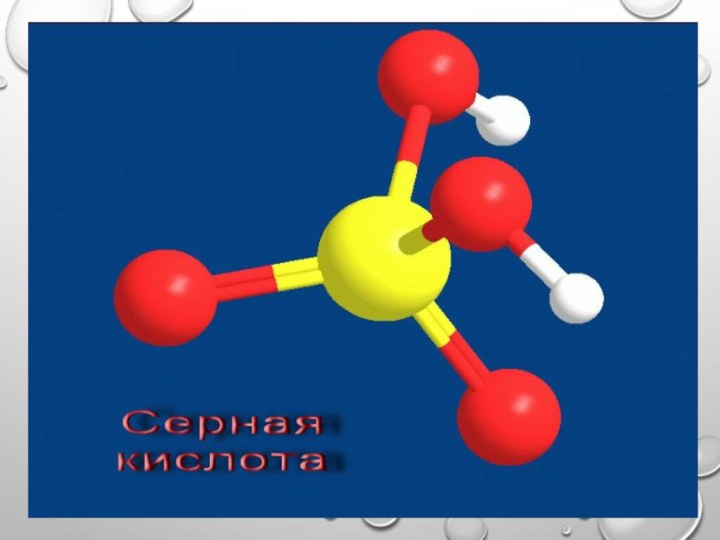
Серная кислота
бесцветная , вязкая жидкость, без запаха, вдвое
тяжелее воды, поглощает влагу из воздуха и других газов,
обугливает древесину, кожу, ткани, бумагу.
Слайд 16
Обугливание лучинки серной кислотой
Слайд 17
Обугливание сахара серной кислотой
Слайд 18
Обугливание бумаги серной кислотой
Слайд 19
Соляная кислота
Соляная кислота содержится желудочном соке (около 0,3%)
способствует пищеварению и
убивает болезнетворные бактерии.
Соляная кислота (хлороводородная) одноосновная
кислота, «дымящая» на воздухе, бесцветная едкая жидкость с острым запахом хлористого водорода.
Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути.
Слайд 20
Правило разбавления кислот
При растворении кислоты нужно вливать ее
тонкой струей в воду и перемешивать.
Запомните правило: сначала вода,
потом кислота, иначе случится большая беда!!!
Слайд 22
ЕСЛИ КИСЛОТА ПОПАЛА НА КОЖУ.
Пораженный участок кожи промывают
сильно скользящей струей холодной воды в течение 10 –
15 мин. После промывки на обожженное место накладывают пропитанную водным 2%-м раствором питьевой соды марлевую повязку или ватный тампон. Через 10 мин. повязку снимают, кожу обмывают, осторожно удаляют влагу фильтровальной бумагой или мягкой тканью и смазывают глицерином для уменьшения болевых ощущений
Слайд 23
H2CO3 → CO2↑ + H2O
H2SO3 → SO2↑ +
H2O
В свободном виде не существуют.
Они распадаются на воду и
соответствующие оксиды.
Слайд 24
Как узнать какие оксиды соответствуют данным кислотам?
Помните, что
суммарная степень окисления атомов всех элементов в соединении равна
нулю, а степени окисления водорода + 1 и кислорода – 2.
Тогда по формуле кислоты можно составить уравнение.
Например в формуле H2SO4 степень окисления серы обозначим за Х, тогда
(+1) ∙ 2 + (- 2) ∙ 4 = 0, откуда Х = + 6
Серной кислоте H2SO4, в которой у серы степень окисления равна + 6, соответствует оксид серы (VI) –SO3
Конспект, выучить формулы оксидов, соответствующих кислотам
Слайд 26
СОЛИ КАК ПРОИЗВОДНЫЕ КИСЛОТ И ОСНОВАНИЙ
8 класс
Слайд 27
Поиграем в крестики –нолики: выберите кратчайший путь,
который составляют кислоты
Слайд 28
Поиграем в крестики –нолики: выберите кратчайший путь,
который составляют двухосновные кислоты
Слайд 29
Поиграем в крестики –нолики: выберите кратчайший путь, который
составляют кислородсодержащие кислоты
Слайд 30
Проверь себя
В кислой среде синий лакмус становится:
фиолетовым
красным
малиновым
не
изменяет окраску
Слайд 31
Проверь себя
Установите соответствие
оксид – гидроксид:
1) Серная кислота
H2SO4 -
2) Азотная кислота HNO3 –
3) Угольная кислота
H2CO3 –
4) Фосфорная кислота H3PO4 -
Слайд 32
Вспомните правило разбавления кислот
Слайд 33
NO
HNO3
NaOH
HNO2
К какому классу соединений относятся вещества,
дать им
названия
Слайд 34
CO
2
2
H CO
Mg(OH)
2
3
H SO
2
3
H SO
2
4
К какому классу соединений относятся
вещества,
дать им названия
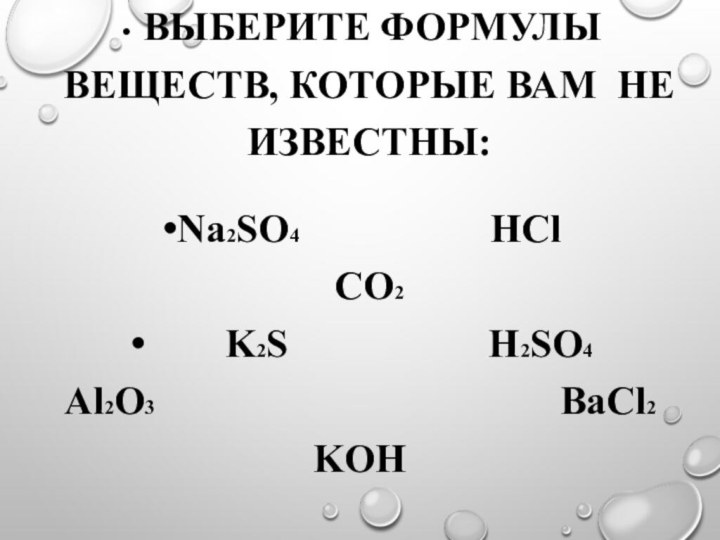
Выберите формулы
веществ, которые вам не известны:
Na2SO4 HCl CO2
K2S H2SO4
Al2O3 ВаCl2 KOH
Слайд 36
Чем объединены и чем отличаются перечисленные соединения?
Na2SO4
K2S
ВаCl2
Cu(NO3)2 CaSiO3
K3PO4
Слайд 37
СОЛИ КАК ПРОИЗВОДНЫЕ КИСЛОТ И ОСНОВАНИЙ
8 класс
Слайд 38
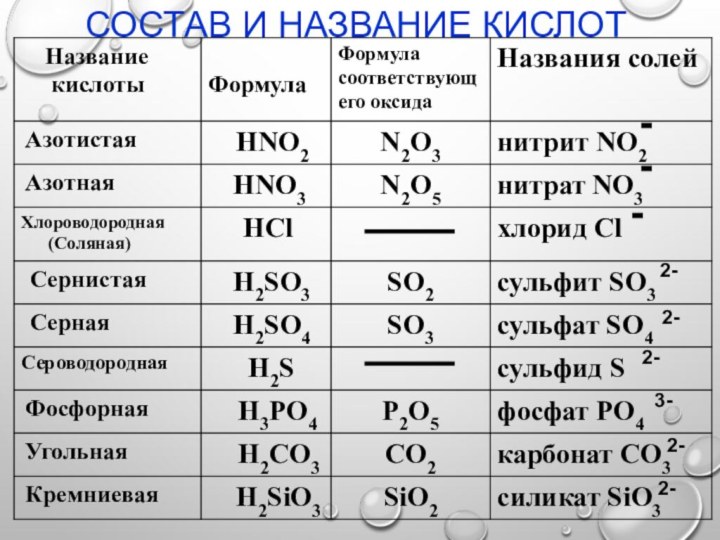
Состав и название кислот
-
-
-
2-
2-
2-
3-
2-
2-
Слайд 39
Cоли – это сложные
вещества, состоящие из ионов металла
и кислотного остатка.
СОЛИ
Соли
Одно химическое соединение
в довольно чистом виде имеется в каждом доме, в каждой семье. Это – поваренная соль или как ее называют химики – хлорид натрия NaCl.
Соли
Гипс – кристаллогидрат
сульфата кальция
СаSO4 * 2H2O
Соли
Из мрамора (СаСО3)
сделан дворец в Индии
Тадж- Махал
Слайд 45
Составить формулу сульфата алюминия:
Составьте формулы:
сульфата натрия,
сульфата
кальция,
сульфата железа(III).
Al
2
+
SO
4
3
3
2
(
)
Слайд 46
Как определить степени окисления элементов в соли?
1. Сульфат
железа (III)
2. расставить известные с.о.
3. Перемножить число атомов каждого
элемента на его заряд
4. Разделить полученное число на число атомов «неизвестного» элемента
5. Поменять знак заряда
6. записать полученное число в формулу
1.
3. +3*2 + (-2)*4*3 =+6-24 = -18
4. -18:3 = -6
5. -6 => +6
6.
Fe2(SO4)3
2. Fe2(SO4)3
+3
-2
Fe2(SO4)3
+3
-2
+6
х
Слайд 47
Химический диктант
Вариант 1
Вариант 2
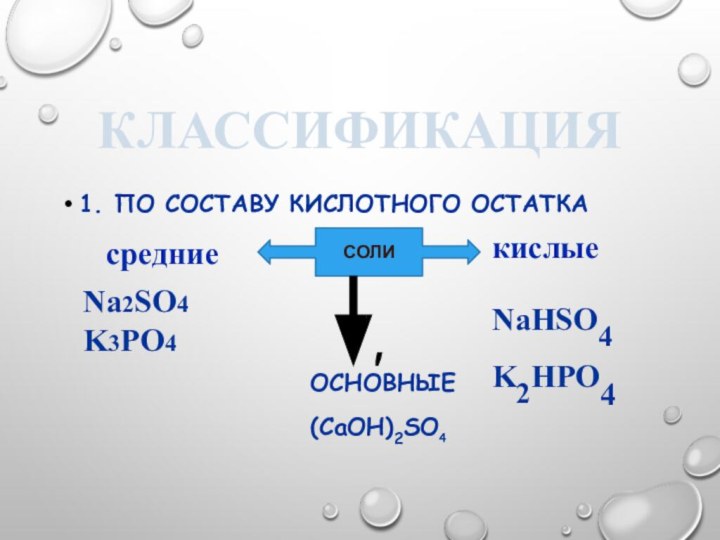
По составу кислотного остатка
основные
(CaOH)2SO4
СОЛИ
средние
кислые
Na2SO4
K3PO4
NaHSO4
K2HPO4
′
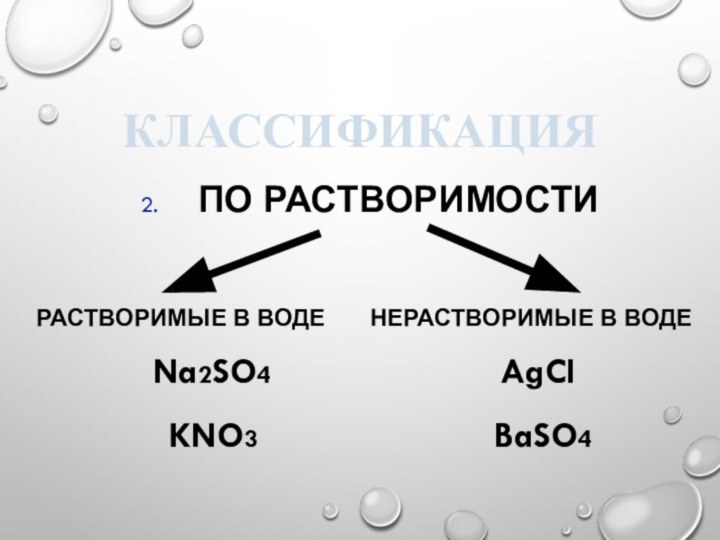
Классификация
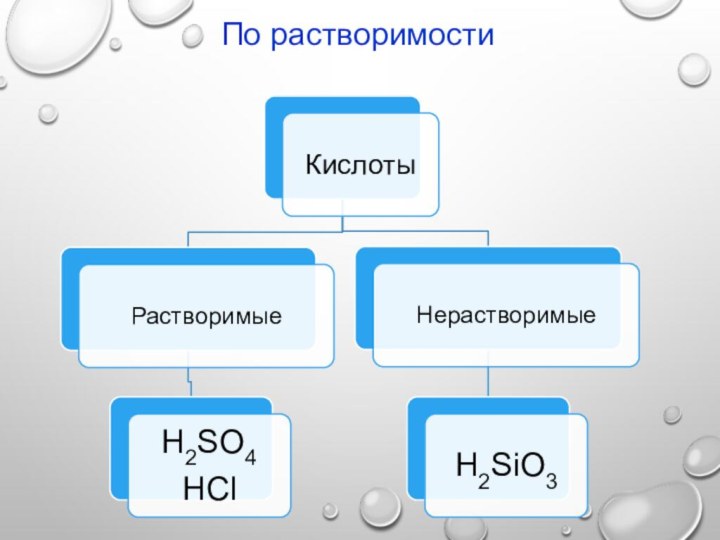
2. По растворимости
Растворимые в воде
нерастворимые в воде
Na2SO4 AgCI
KNO3 BaSO4
Слайд 50
ЗАКРЕПЛЕНИЕ
1. Что такое соли?
2. Дать названия веществам: Ca(NO3)2,
K2SO3, Li2CO3, CuSO4. Определить растворимость этих веществ.
3. Составить формулы
солей: нитрита магния, силиката натрия, фосфата кальция.