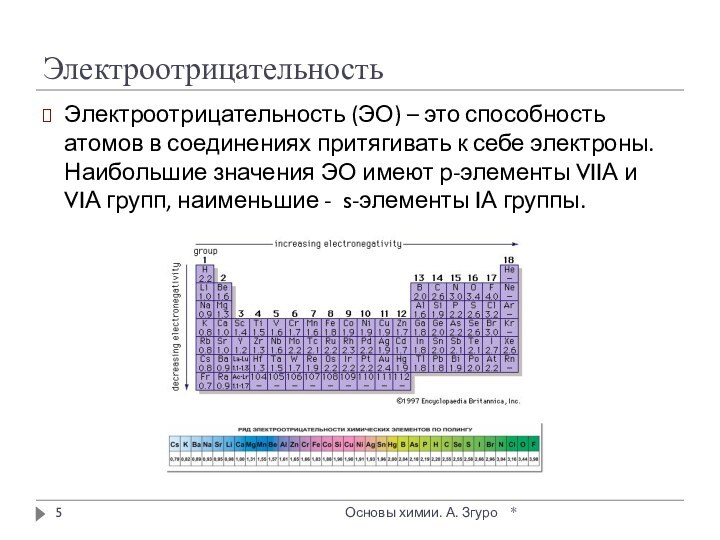
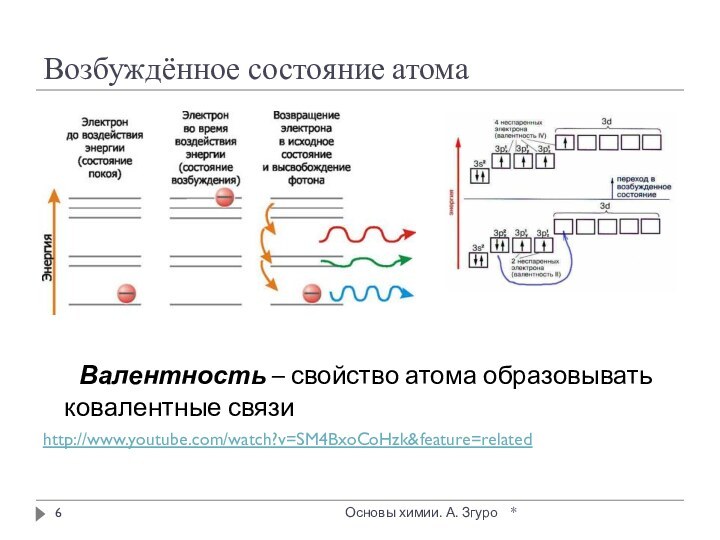
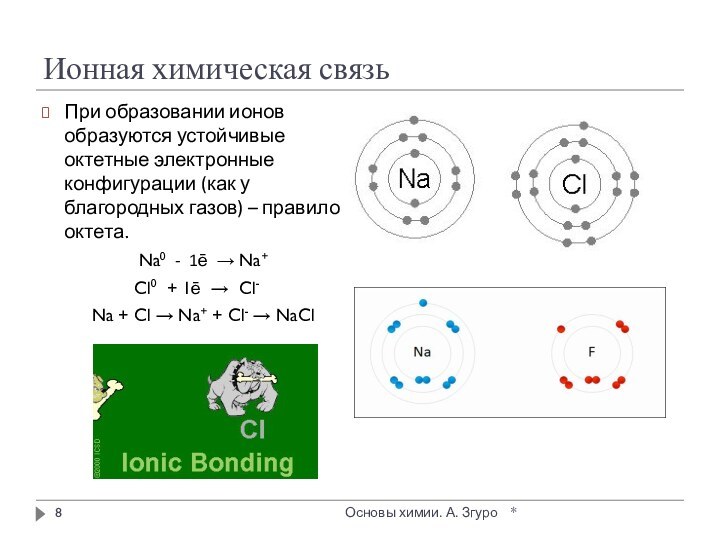
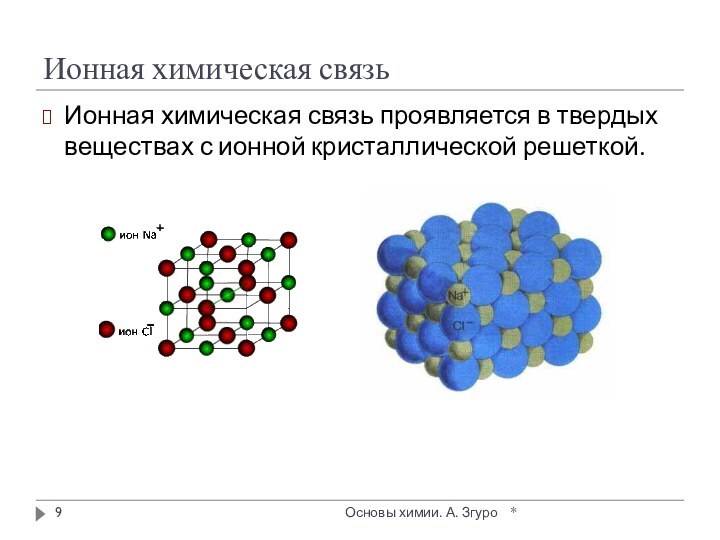
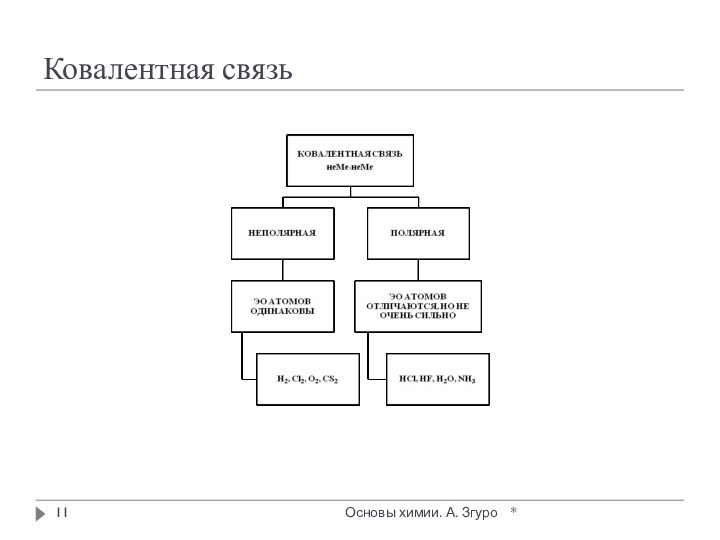
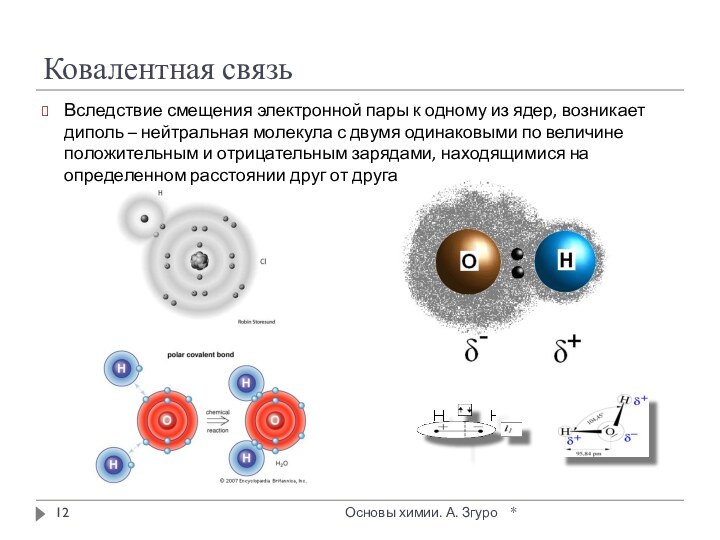
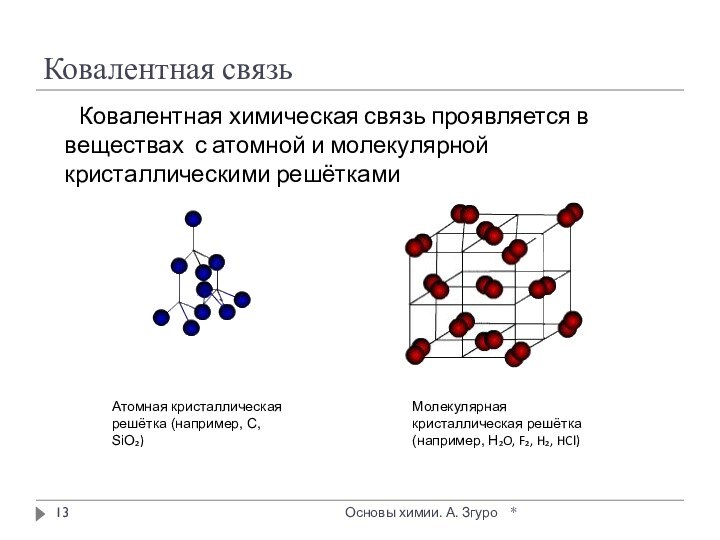
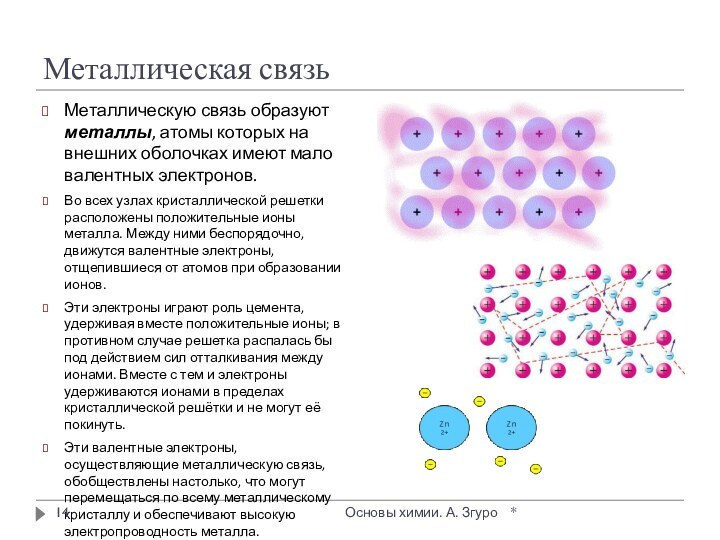
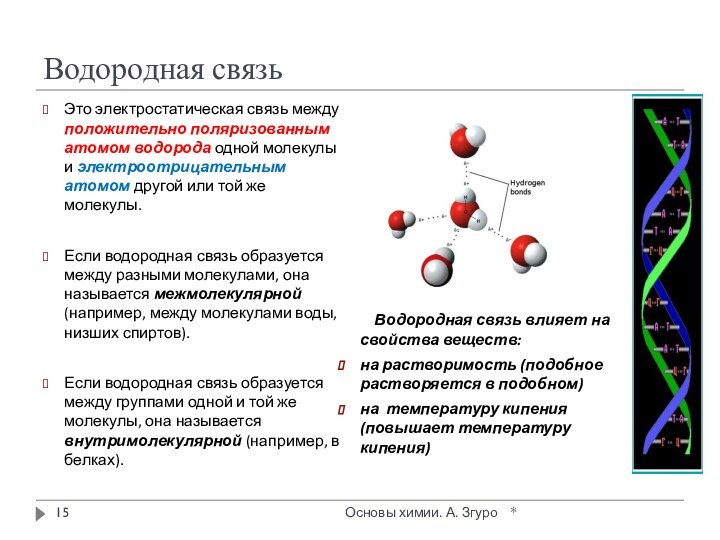
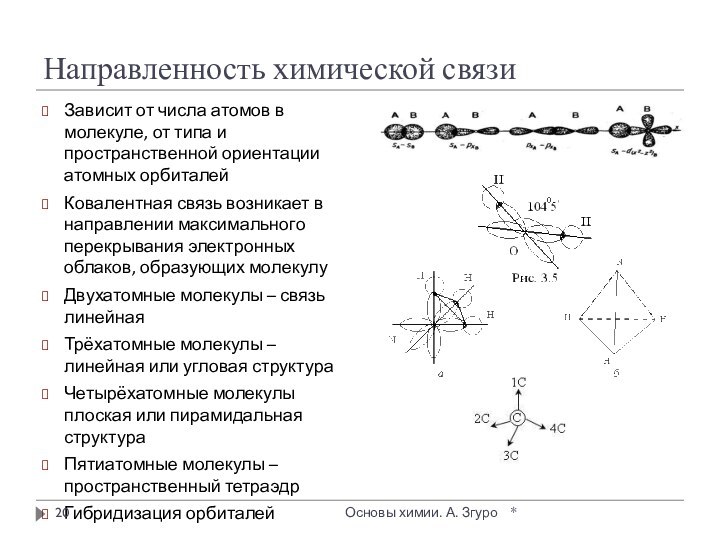
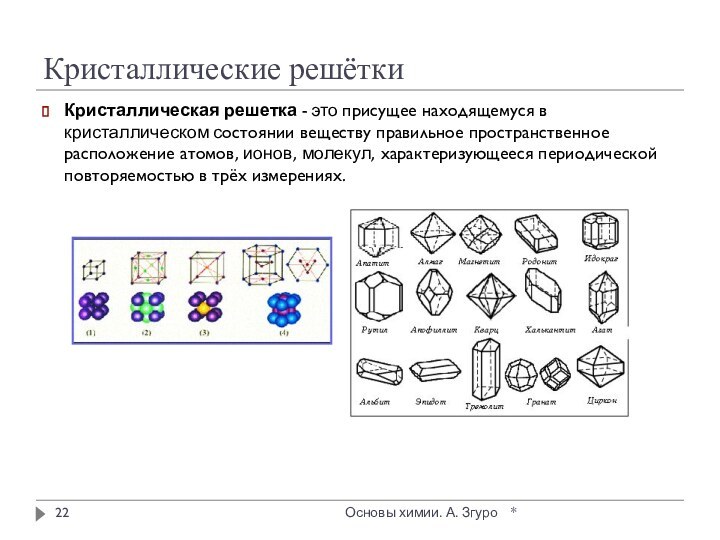
внутри которых атомы соединены ковалентными связями.
Между молекулами действуют
более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Кристалл льда (H₂O)
Кристалл СО₂ (сухой лёд)
Кристалл иода I₂
*
Основы химии. А. Згуро