Слайд 2
Цели урока
Изучить предельные углеводороды на примере метана
Рассмотреть строение
молекул метана и его гомологов.
Изучить физические и химические свойства
алканов.
Ознакомиться с изомерией и номенклатурой алканов.
Слайд 3
Вспомните, какие вещества мы называем углеводородами?
УГЛЕВОДОРОДЫ –
это органические
соединения,
состоящие из двух химических
элементов – УГЛЕРОДА И ВОДОРОДА.
Слайд 4
АЛКАНЫ (предельные, насыщенные, парафины) –
это углеводороды с общей
формулой
CnH2n+2, которые не способны на
реакции присоединения
Слайд 5
АЛКАНЫ
название предельных углеводородов
по международной номенклатуре (ИЮПАК).
ПАРАФИНЫ
исторически сохранившееся
название предельных углеводородов (от лат. parrum affinis – малоактивный).
Слайд 6
Строение предельных углеводородов
Алканы – углеводороды, в молекулах
которых атомы связаны одинарными связями и которые соответствуют общей
формуле CnH2n+2.
В молекулах алканов все атомы углерода находятся в состоянии SP3 – гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды – тетраэдра. Углы между орбиталями равны 109 градусам 28 минутам.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Слайд 7
Каждая sp3- гибридная орбиталь при перекрывании с
s-орбиталью атомов водорода образует с ними четыре, так называемые,
σ- связи.
σ- Связь – это одинарная ковалентная связь, образованная при перекрывании
орбиталей по прямой, соединяющей ядра
атомов, с максимумом перекрывания на этой прямой.
Слайд 8
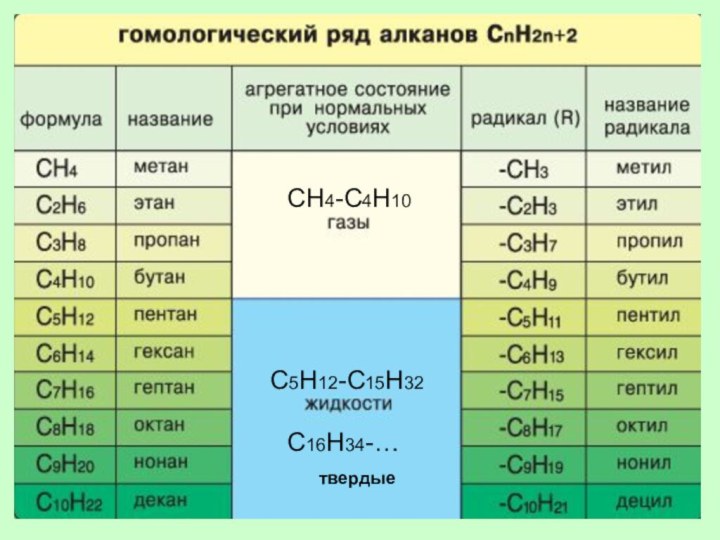
ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ
Вспомните, какие вещества
мы называем гомологами?
ГОМОЛОГИ –
это вещества со схожими
строением
и свойствами,
но различающиеся по составу
на одну или несколько групп CH2 (гомологическая разность).
Слайд 9
СН4-С4Н10
С5Н12-С15Н32
С16Н34-…
твердые
Слайд 10
Какое же пространственное строение будут иметь гомологи метана?
этан
пентан
Молекулы
алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все
параметры молекулы метана: длина связи, размер угла между атомами, тип гибридизации
Слайд 11
Номенклатура
За основу принимают название углеводорода, которому соответствует в
рассмотренном соединении самая длинная цепь.
Эта цепь нумеруется, начиная с
того конца, к которому ближе радикал-заместитель.
В названии вещества цифрой показывают место радикала-заместителя и называют заместитель.
Затем называют углеводород, которому отвечает главная цепь.
Слайд 12
Изомерия
Для алканов характерна
изомерия углеродного скелета. Многочисленность углеводородов объясняется явлением изомерииДля алканов
характерна изомерия углеродного скелета. Многочисленность углеводородов объясняется явлением изомерии. С возрастанием числа атомов углерода в молекуле число изомеров резко увеличивается. Так, у бутана – 2, у пентана -3, у гексана – 5, у декана – 75.
CH3-CH2-CH2-CH3 CH3 – CH – CH3
н-бутан |
2-метилпропан CH3
Слайд 13
Изомерия
Изомерия – явление, при котором вещества,
имеющие один и
тот же качественный и
количественный состав, отличаются по своим
свойствам.
Изомеры
– химические соединения, имеющие
одинаковый состав и молекулярную массу,
но отличающиеся строением молекул,
физическими и химическими свойствами.
Слайд 14
ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре.
СН3
СН3 – СН2 – С – СН3
СН3
2,2 - диметилбутан
СН3 – СН – СН – СН – СН3
СН3 С2Н5 СН3
2,4 – диметил - 3 – этилпентан
Слайд 15
Запомните!
Алканы получают:
1. Из нефти;
2. Из природного
и попутного газа;
3. Из солей карбоновых кислот (реакция Дюма);
4.
Из галогеналканов (синтезы Вюрца и Вюрца-Гриньяра);
5. Электролизом по Кольбе.
Слайд 16
Физические свойства
Метан – газ без цвета и
запаха, почти в 2 раза легче воздуха, мало растворим
в воде. Этан, пропан, бутан при нормальных условиях – газы, от пентана до пентадекана – жидкости, а следующие гомологи – твердые вещества.
Температуры плавления и кипения алканов,
их плотности увеличиваются с ростом
молекулярной массы.
Все алканы легче воды, в ней не
растворимы, однако растворимы в
неполярных растворителях (например, в
бензоле) и сами являются хорошими
растворителями.
Слайд 17
Химические свойства
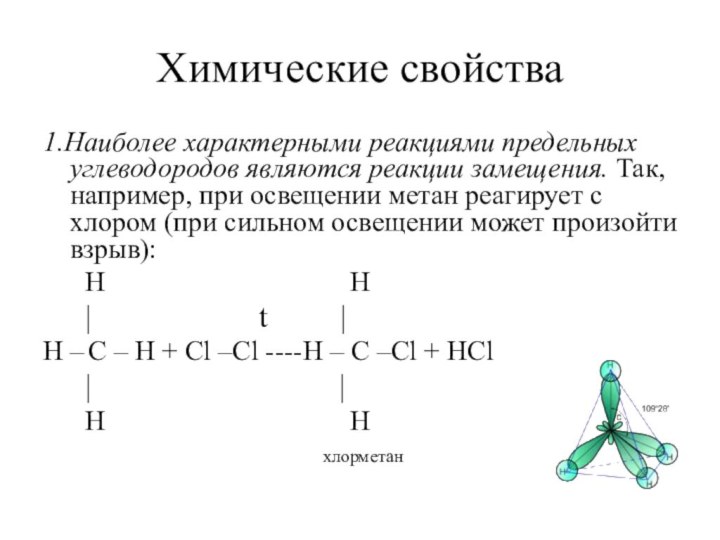
1.Наиболее характерными реакциями предельных углеводородов являются
реакции замещения. Так, например, при освещении метан реагирует с
хлором (при сильном освещении может произойти взрыв):
H H
| t |
H – C – H + Cl –Cl ----H – C –Cl + HCl
| |
H H
хлорметан
Слайд 18
2) При нагревании их до 140°С с разбавленной
(10%-ной)
азотной кислотой под давлением
Осуществляется реакция нитрования –
замещение атома водорода
нитрогруппой
(реакция М.И.Коновалова). Наилучшие
результаты наблюдаются с алканами,
содержащими третичные углеродные атомы.
t,p
CH3–CH(CH3)–CH3 +HO-NO2 →CH3-C (CH3)–CH3 + H2O
|
NO2
3) Сульфирование – замещение атома водорода
сульфогруппой. При нагревании конц. серная
кислота («дымящаяся») дает с высшими парафинами
сульфокислоты.
R-H + H2SO4 → R-SO3H + H2O
Слайд 19
Запомните!
Для алканов характерны реакции замещения атомов водорода
на другие атомы или группы атомов.
В этих реакциях водород
никогда не выделяется, а образуется галогеноводород.
Замещение у алканов идет в первую очередь по менее гидрогенизированному атому углерода.
Слайд 20
Применение
Применяется в виде природного газа метан используется
в качестве топлива. Метан является исходным продуктом для получения
метанола, уксусной кислоты, синтетических каучуков, синтетического бензина и многих других ценных продуктов.