- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Лекция 8.3. Реакции окисления и восстановления органических соединений
Содержание
- 2. В результате окисления веществ выделяется энергия, которая
- 3. Химические реакции, в процессе которых происходит перенос
- 4. Восстановители – доноры электроновОкислители – акцепторы электронов
- 5. В органической химии под окислением понимают реакции,
- 6. Схема реакции окисления
- 7. Механизмы окисления и восстановления Прямой перенос ē
- 8. 2. Перенос атома водорода (свободнорадикальный разрыв
- 9. 4. Перенос электронов путем прямого взаимодействия органического восстановителя с кислородом, приводящий к продукту с ковалентно-связанным кислородом
- 10. Примером последней реакции может служить алифатическое гидроксилирование
- 11. Взаимодействие ЛС с кислородом происходит в митохондриях
- 12. Примерами реакций окисления и восстановления являются реакции дегидрирования и гидрирования
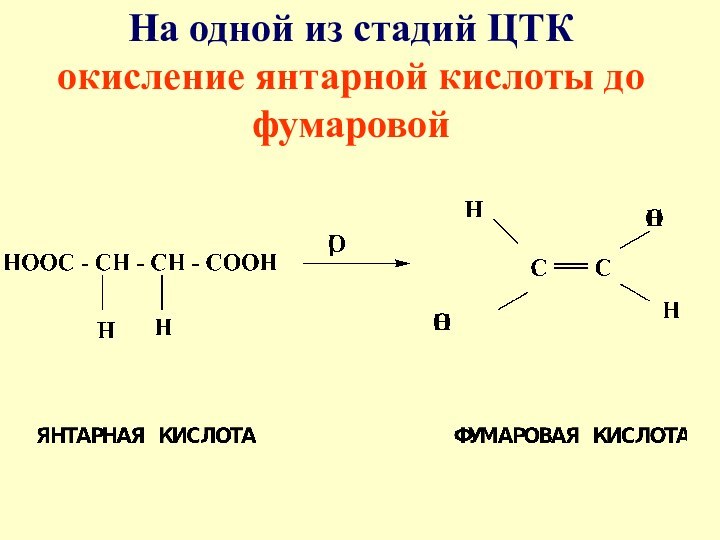
- 13. На одной из стадий ЦТК окисление янтарной кислоты до фумаровой
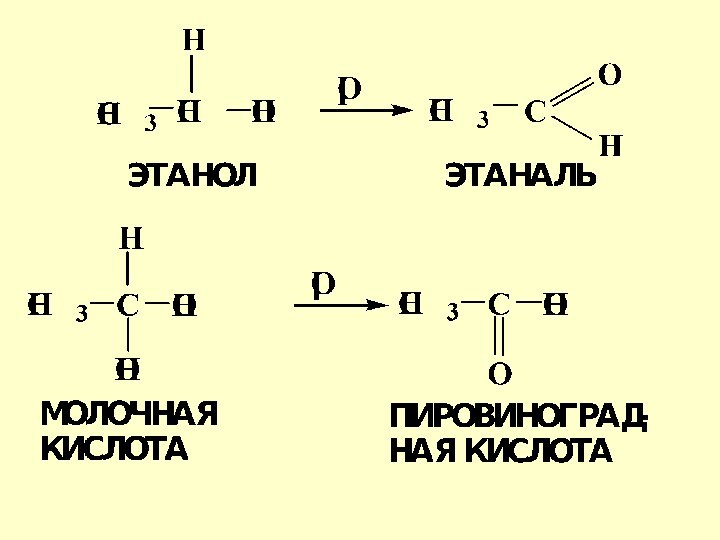
- 14. Окисление гидроксильных и оксогруппСпирты обладают большей способностью
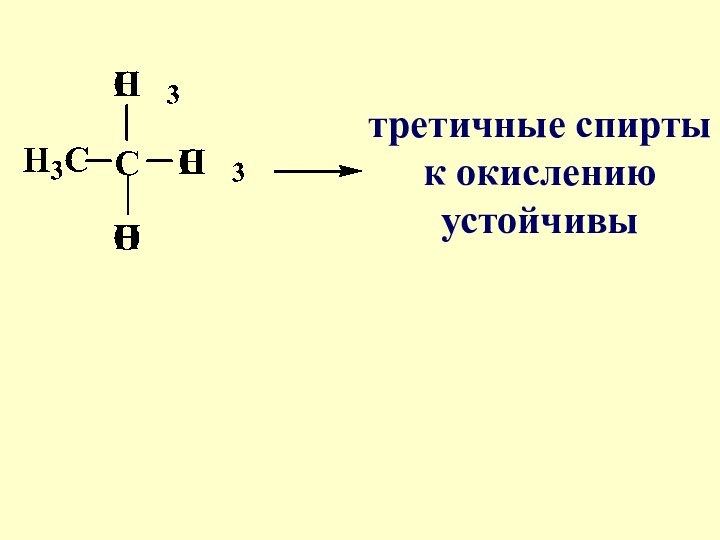
- 16. третичные спирты к окислению устойчивы
- 17. Альдегиды легко окисляются до соответствующих кислот[O]: KMnO4,
- 18. Кетоны к окислению устойчивы
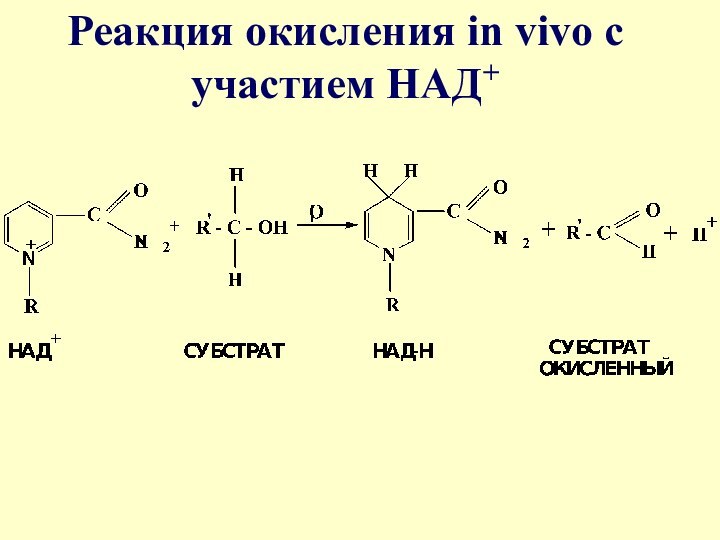
- 19. Реакция окисления in vivo с участием НАД+
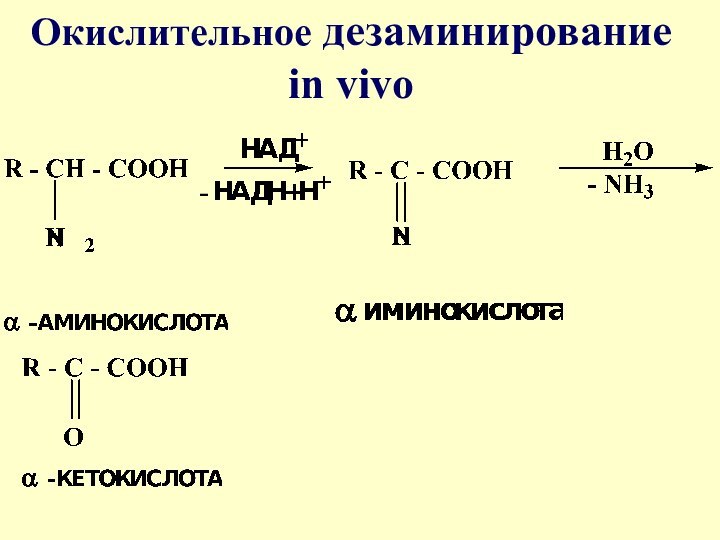
- 20. -Окислительное дезаминирование in vivo
- 21. Реакции восстановленияРеакции восстановления обратны реакциям окисления: восстановление
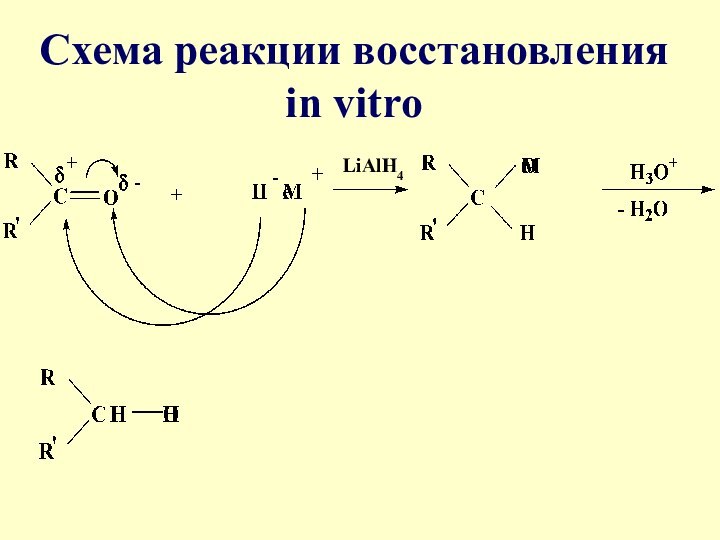
- 22. В качестве восстанавливающего агента in vitro используют алюмогидрид лития LiAlH4 или гидриды щелочных металлов
- 23. Схема реакции восстановления in vitro LiAlH4
- 24. Схема реакции восстановления in vivo
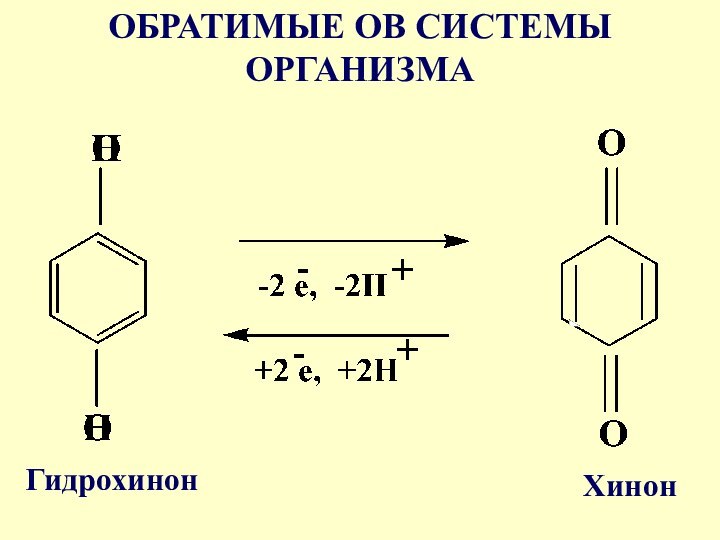
- 25. Обратимые ОВ системы организмаК ним относятся системы
- 26. ОБРАТИМЫЕ ОВ СИСТЕМЫ ОРГАНИЗМАГидрохинонХинон
- 27. Система гидрохинон-хинон входит в состав кофермента Q-убихинон,
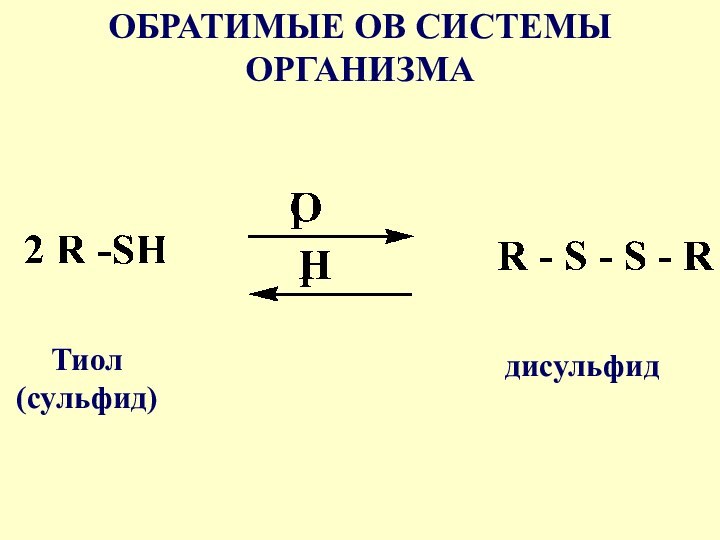
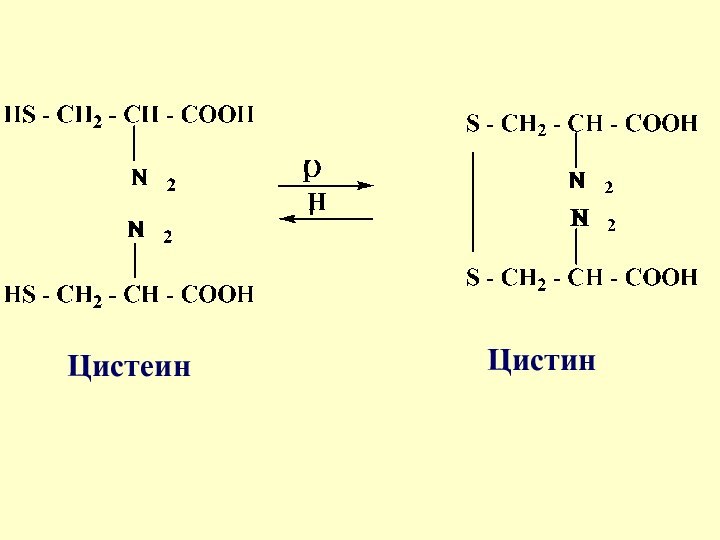
- 28. Обратимая ОВ реакция в системе сульфид-дисульфид играет важную роль в формировании пространственной структуры белков
- 29. ОБРАТИМЫЕ ОВ СИСТЕМЫ ОРГАНИЗМАТиол
- 30. Скачать презентацию
- 31. Похожие презентации
В результате окисления веществ выделяется энергия, которая запасается в форме высокоэнергетических соединений, таких как АТФ, а затем расходуется в процессе анаболизма. Реакция окисления способствует детоксикации и выведению ксенобиотиков













![Лекция 8.3. Реакции окисления и восстановления органических соединений Альдегиды легко окисляются до соответствующих кислот[O]: KMnO4, CrO3, [Ag(NH3)2]OH –реактив Толленса, Cu(OH)2](/img/tmb/15/1428030/84975d7bf193b2383ab059a6e4240699-720x.jpg)







Слайд 3 Химические реакции, в процессе которых происходит перенос электронов
от одной молекулы к другой, называются ОВ
Окисление - процесс отдачи электронов молекулой, восстановление – приобретение электроновСлайд 5 В органической химии под окислением понимают реакции, при
которых происходит
удаление из молекулы атомов водорода или образование более полярных связей из менее полярных
Слайд 7
Механизмы окисления и восстановления
Прямой перенос ē (одноэлектронный
перенос)
Fе2+– ē → Fе3+Эта ОВ пара может отдавать свои электроны любому восстанавли-вающемуся соединению