- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме: Предельные углеводороды
Содержание
- 2. Углеводороды (УВ) - органические соединения, состоящие из атомов водорода и углерода
- 3. Классификация углеводородовпо признакамстроение углеродного скелетастепень насыщенности (наличие в цепи кратных связей С=С и С≡C)
- 5. насыщенные (предельные) углеводороды, в которых имеются только одинарные
- 6. Арены (ароматические УВ)по составу бензол соответствуют ненасыщенным циклическим углеводородам по свойствам это соединение резко отличается
- 7. Предельные углеводороды
- 8. 1. определениепредельные УВ - углеводороды, в которых
- 9. 2. возможные названияалканы название предельных углеводородов по
- 11. 3. Номенклатура ИЮПАК (IUPAC)1. Выбирается самая длинная
- 12. 3. Номенклатура ИЮПАК (IUPAC)4. Количество одинаковых заместителей
- 19. Простейшие представители
- 20. Модели молекул
- 21. 4. Физические свойства алкановс увеличением числа углеродных
- 22. 5. Строение алканов1. два типа химических связей:
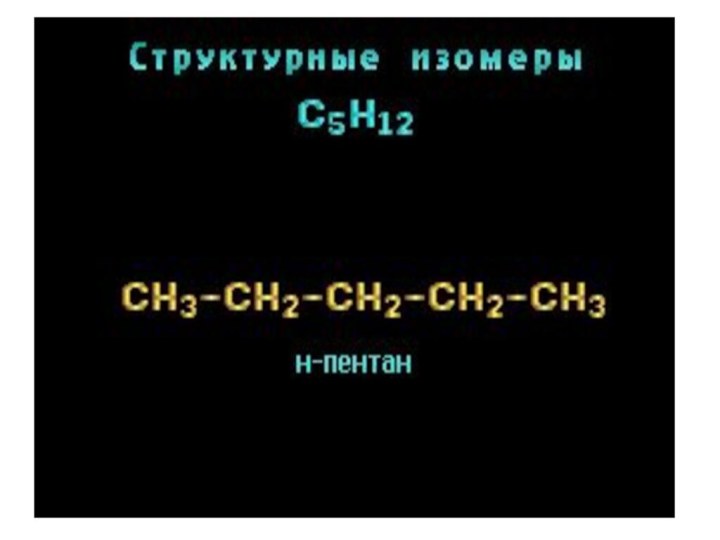
- 25. 6. Виды изомерии алкановизомерия углеродного скелета
- 27. с увеличением числа атомов углерода увеличивается количество изомеров
- 28. Изомерия алканов 2. поворотная изомерия возникает из-за
- 29. Поворотная изомерияповоротные изомеры не удается выделить в
- 31. конформация А энергетически не выгодна конформация Б более выгодна
- 32. наиболее устойчивым является конформер IV
- 33. Изомерия алканов3. оптическая изомерияесли атом углерода в
- 34. молекулы таких соединений относятся друг к другу
- 35. Молекулы оптических изомеров несовместимы в пространстве
- 36. оптическими изомерами называются пространственные изомеры, молекулы которых
- 37. 7. Химические свойства алканов1) реакции замещения галогенирование
- 38. хлорирование метана
- 39. легче всего идет замещение водорода у третичного атома, потом у вторичного и труднее всего у первичного
- 40. нитрование (р-ция Коновалова) на алканы действует pазбавленная
- 41. 7. Химические свойства алканов 2) крекинг –
- 42. 2а. Термический крекингпри температуре 450–700 oС образуются
- 44. 2б. Каталитический крекинг проводят в присутствии катализаторов
- 45. 7. Химические свойства алканов3) Изомеризация алканов
- 46. 7. Химические свойства алканов4) дегидрирование алканов -
- 47. низшие алканы ( 2-4 атома С)при нагревании
- 48. н-пентан и его производныепри нагревании над Pt-катализатором
- 49. в цепи в 6 и более атомов
- 50. при 1500 °С происходит межмолекулярное дегидрирование метана
- 51. 7. Химические свойства алканов5) Реакции окисления при
- 52. частичное окислениепри относительно невысокой температуре и с
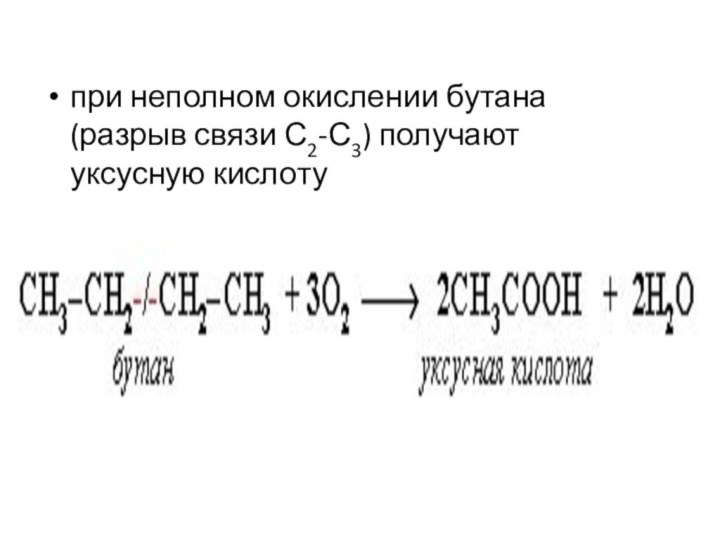
- 53. при неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту
- 54. высшие алканы (n>25) под действием кислорода воздуха
- 55. "синтез-газ"это смесь оксида углерода (II) с водородом
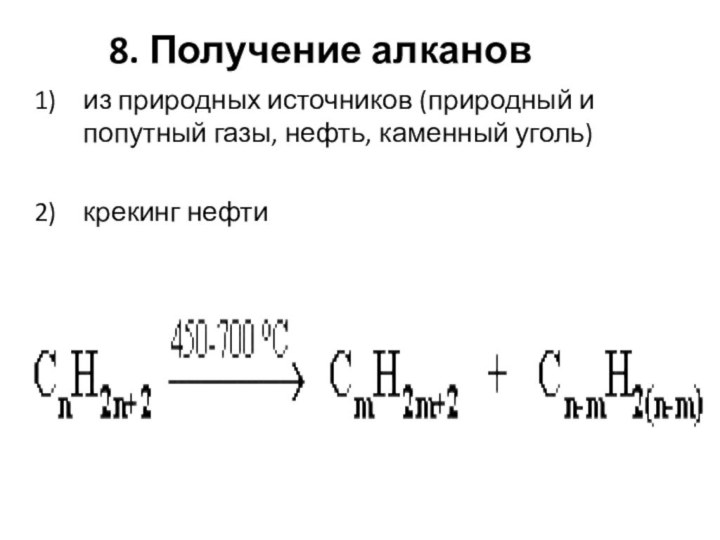
- 56. 8. Получение алканов из природных источников (природный и попутный газы, нефть, каменный уголь)крекинг нефти
- 57. 8. Получение алканов3) Гидpиpование непpедельных углеводоpодов
- 58. 8. Получение алканов4) Газификация твердого топлива при повышенной температуре и давлении, катализатор Ni
- 59. 8. Получение алканов5) Из синтез-газа (СО + Н2)
- 60. 6) реакция Вюpца8. Получение алканов
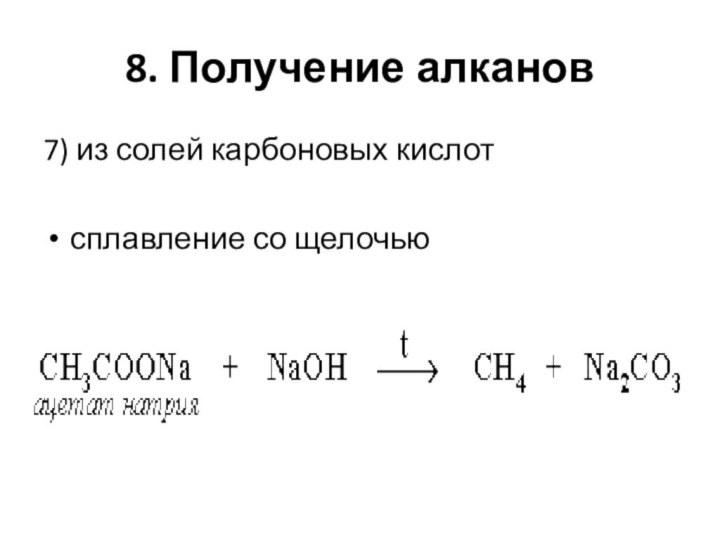
- 61. 8. Получение алканов7) из солей карбоновых кислот сплавление со щелочью
- 62. 8. Получение алканов7) из солей карбоновых кислот электролиз
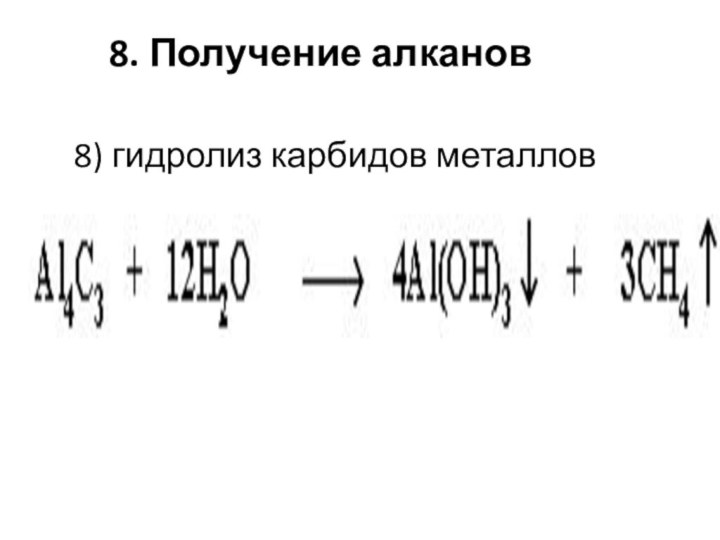
- 63. 8. Получение алканов8) гидролиз карбидов металлов
- 64. 9. Применение алкановгазообразные алканы - ценное топливо
- 65. 9. Применение алкановпаpафин - для изготовления свечей,
- 66. Скачать презентацию
- 67. Похожие презентации
Углеводороды (УВ) - органические соединения, состоящие из атомов водорода и углерода
























































Слайд 3
Классификация углеводородов
по признакам
строение углеродного скелета
степень насыщенности (наличие в
цепи кратных связей С=С и С≡C)
Слайд 5
насыщенные (предельные) углеводороды, в которых имеются только одинарные связи
ненасыщенные (непредельные)
углеводороды , содержащие кроме одинарных, двойные и/или тройные связи
Слайд 6
Арены (ароматические УВ)
по составу бензол соответствуют ненасыщенным циклическим углеводородам
по свойствам это соединение резко отличается
Слайд 8
1. определение
предельные УВ - углеводороды, в которых атомы
углерода связаны между собой одинарными связями в неразветвленные или
разветвленные цепиили
предельные УВ - углеводороды, состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода
Слайд 9
2. возможные названия
алканы название предельных углеводородов по международной
номенклатуре (ИЮПАК)
парафины– исторически сложившееся название, отражающее свойства этих соединений
(от лат. parrum affinis – имеющий мало сродства, малоактивный)предельными, или 4. насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода
Слайд 11
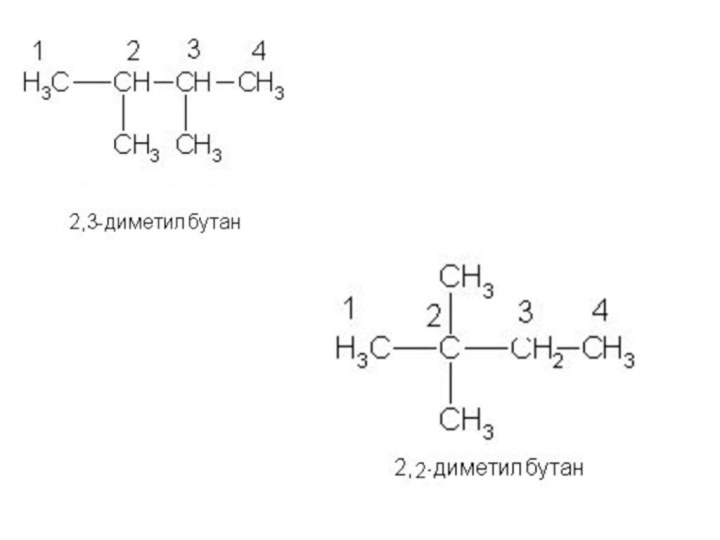
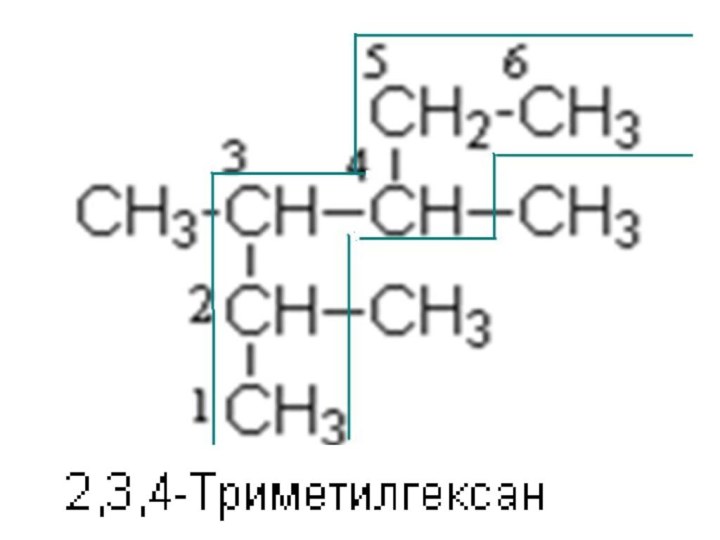
3. Номенклатура ИЮПАК (IUPAC)
1. Выбирается самая длинная углеродная
цепь - главная цепь.
2. Нумерация главной цепи проводится так,
чтобы положение заместителя (радикала) или сумма положений заместителей (если их несколько) имели бы минимальное значение.3. Название заместителя строится из названия соответствующего алкана с заменой суффикса -ан на суффикс -ил.
метан - метил этан - этил
Слайд 12
3. Номенклатура ИЮПАК (IUPAC)
4. Количество одинаковых заместителей обозначается
соответствующей приставкой:
2 шт. - ди-;
3 шт. - три-; 4 шт. - тетра-; 5 шт. - пента- и т.д.
5. Если в молекуле содержится несколько видов заместителей, то они перечисляются в алфавитном порядке.
6. Структура названия:
цифры (через ,,,,) - приставка + заместитель + алкан главной цепи.
Слайд 21
4. Физические свойства алканов
с увеличением числа углеродных атомов
повышаются
температуры кипения и плавления, увеличивается плотность
от СН4 до С4Н10–
газыот С5Н12 до С17Н36 – жидкости
С18Н38 и далее – твердые вещества
алканы с разветвленным строением кипят при более низкой температуре, чем их неразветвленные изомеры
Слайд 22
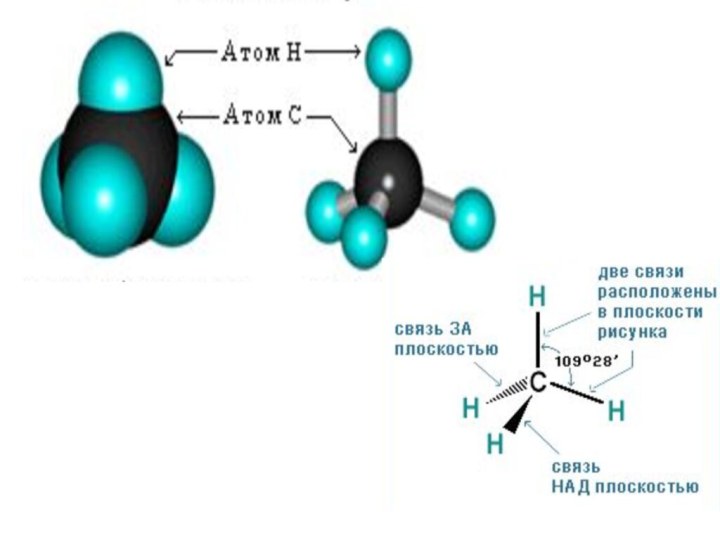
5. Строение алканов
1. два типа химических связей:
С–С ковалентная неполярная
С–Н ковалентная слабополярная2. sp3 - гибридизация
3. валентный угол 109о28/
Слайд 28
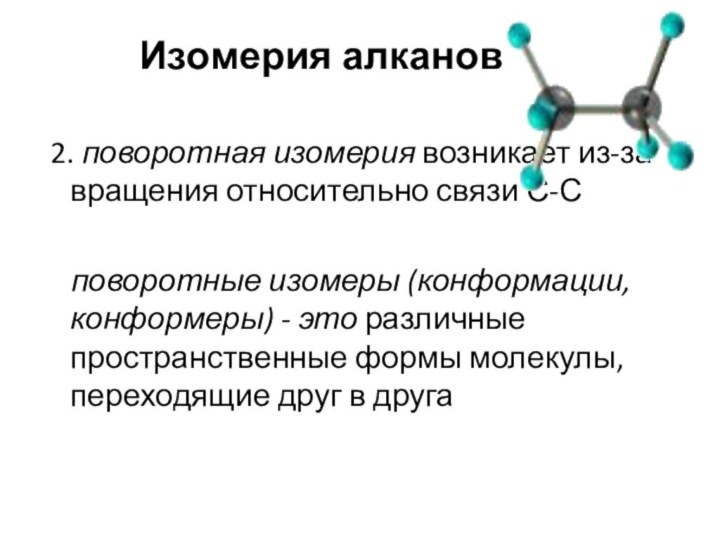
Изомерия алканов
2. поворотная изомерия возникает из-за вращения
относительно связи С-С
поворотные изомеры (конформации, конформеры) - это
различные пространственные формы молекулы, переходящие друг в друга
Слайд 29
Поворотная изомерия
поворотные изомеры не удается выделить в индивидуальном
виде, но их существование доказано физическими методами
некоторые конформации более
устойчивы (энергетически выгодны) и молекула пребывает в таких состояниях более длительное время
Слайд 33
Изомерия алканов
3. оптическая изомерия
если атом углерода в молекуле
связан с четырьмя различными атомами(атомными группами), то существуют соединения,
отличающихся пространственным строениемСлайд 34 молекулы таких соединений относятся друг к другу как
предмет и его зеркальное изображение и являются пространственными изомерами
изомерия
этого вида называется оптическойизомеры – оптические изомеры или оптические антиподы
Слайд 36
оптическими изомерами называются пространственные изомеры, молекулы которых относятся
между собой как предмет и несовместимое с ним зеркальное
изображениеони имеют одинаковые физические и химические свойства, но различаются отношением к поляризованному свету, т.к. обладают оптической активностью
Слайд 37
7. Химические свойства алканов
1) реакции замещения
галогенирование -
реакция замещения одного или более атомов водорода в молекуле
алкана на галоген (Cl, Br, I)нитрование - реакция замещения одного или более атомов водорода в молекуле алкана на нитрогруппу – NO2
Слайд 39 легче всего идет замещение водорода у третичного атома,
потом у вторичного и труднее всего у первичного
Слайд 40
нитрование (р-ция Коновалова)
на алканы действует pазбавленная азотная
кислота пpи нагpевании и давлении
происходит замещение атома водоpода на
нитpогpуппу - NO2
Слайд 41
7. Химические свойства алканов
2) крекинг – процесс
термического разложения углеводородов, в основе которого лежат реакции расщепления
углеродной цепи крупных молекул с образованием соединений с более короткой цепьюможет быть:
2а) термический 2б) каталитический
Слайд 42
2а. Термический крекинг
при температуре 450–700 oС образуются алканы
и алкены с меньшим числом углеродных атомов
разрыв С–С-связи возможен
в любом случайном месте молекулы, поэтому образуется смесь алканов и алкенов
Слайд 44
2б. Каталитический крекинг
проводят в присутствии катализаторов (обычно
Al2O3 и SiO2) при температуре 450°С и атмосферном давлении
при
этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования
Слайд 46
7. Химические свойства алканов
4) дегидрирование алканов - отщепление
атомов водорода за счет разрыва связей С—Н
происходит при нагревании
в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO)строение продуктов дегидрирования зависит от условий реакции и длины цепи в молекуле исходного алкана
Слайд 47
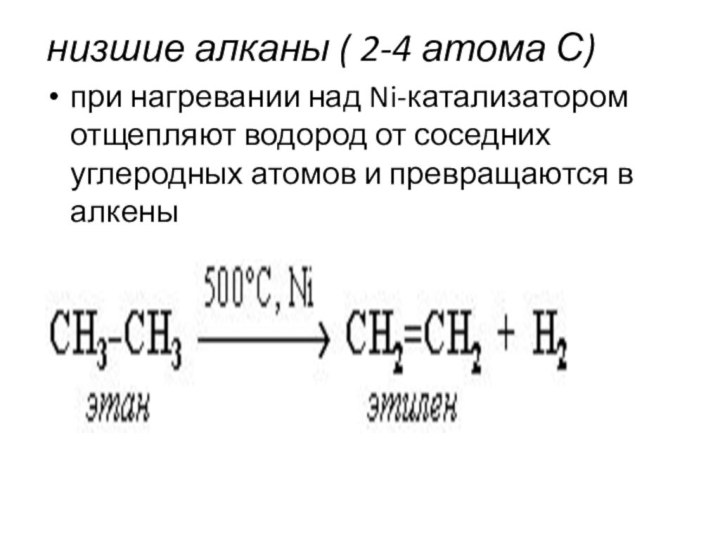
низшие алканы ( 2-4 атома С)
при нагревании над
Ni-катализатором отщепляют водород от соседних углеродных атомов и превращаются
в алкены
Слайд 48
н-пентан и его производные
при нагревании над Pt-катализатором атомы
водорода отщепляются от концевых атомов углеродной цепи, и образуется
пятичленный цикл
Слайд 49
в цепи в 6 и более атомов С
образуется
6-членный цикл
цикл подвергается дальнейшему дегидрированию и превращается в
энергетически более устойчивый цикл арена
Слайд 51
7. Химические свойства алканов
5) Реакции окисления
при обычной
температуре алканы не вступают в реакции даже с сильными
окислителями (Н2Cr2O7, KMnO4 и т.п.)горение:
полное CH4 + 2 O2 CO2 + 2 H2O
неполное 2 CH4 + 3 O2 2 CO + 4 H2O
CH4 + O2 C + 2 H2O
Слайд 52
частичное окисление
при относительно невысокой температуре и с применением
катализаторов разрывается только часть связей С-С и С-Н
это используется
для получения карбоновых кислот, кетонов, альдегидов, спиртов
Слайд 54
высшие алканы (n>25)
под действием кислорода воздуха в
жидкой фазе в присутствии солей марганца превращаются в смесь
карбоновых кислот со средней длиной цепи С12-С18, которые используются для получения моющих средств и поверхностно-активных веществ
Слайд 55
"синтез-газ"
это смесь оксида углерода (II) с водородом
образуется
при взаимодействии метана с водяным паром
синтез-газ служит сырьем для
получения различных углеводородов
Слайд 56
8. Получение алканов
из природных источников (природный и
попутный газы, нефть, каменный уголь)
крекинг нефти
Слайд 58
8. Получение алканов
4) Газификация твердого топлива при повышенной
температуре и давлении, катализатор Ni
Слайд 64
9. Применение алканов
газообразные алканы - ценное топливо
жидкие
углеводоpоды - в моторных и ракетных топливах и в
качестве растворителейвазелиновое масло - в медицине, паpфюмеpии и косметике
Слайд 65
9. Применение алканов
паpафин - для изготовления свечей, пpопитки
спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине
и т.д.нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти