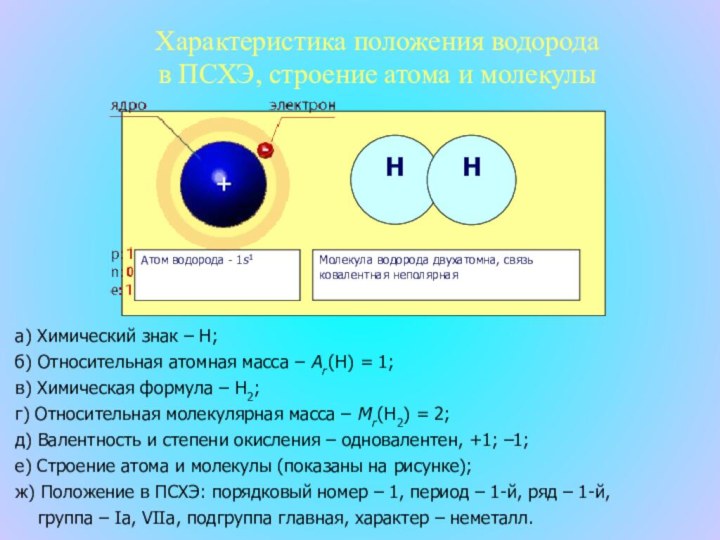
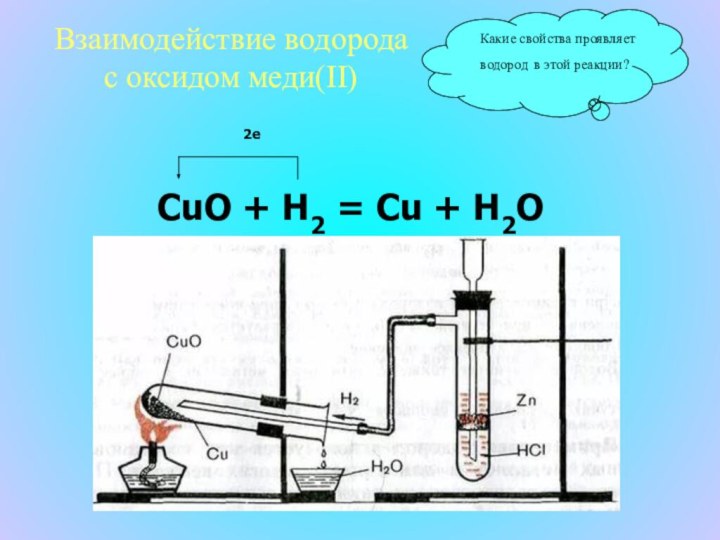
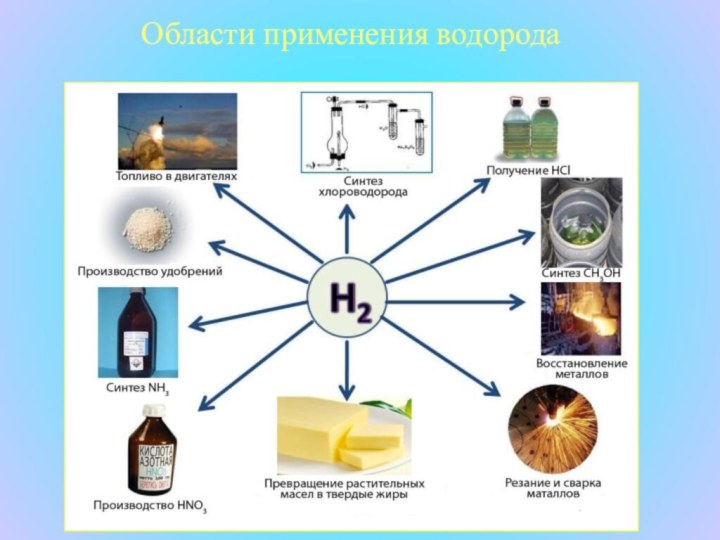
что в недалеком будущем водород станет идеальным топливом, так
как при его сгорании образуется экологически чистое вещество – вода и выделяется огромное количество энергии. Человечество навсегда забудет уголь и нефть как топливные ресурсы. Получать водород возможно будут путем электролиза воды.
Ученые придумали, как использовать водород в качестве горючего и при этом не взорваться. В газ стали добавлять специальные присадки-ингибиторы (химические «тормоза»). Например, пропилен. Всего 1% этого дешевого газа — и водород из грозного оружия превращается в безопасный газ.
В 1979 г. компания BMW выпустила первый автомобиль, вполне успешно ездивший на водороде, при этом не взрывавшийся и выпускавший из выхлопной трубы водяной пар.