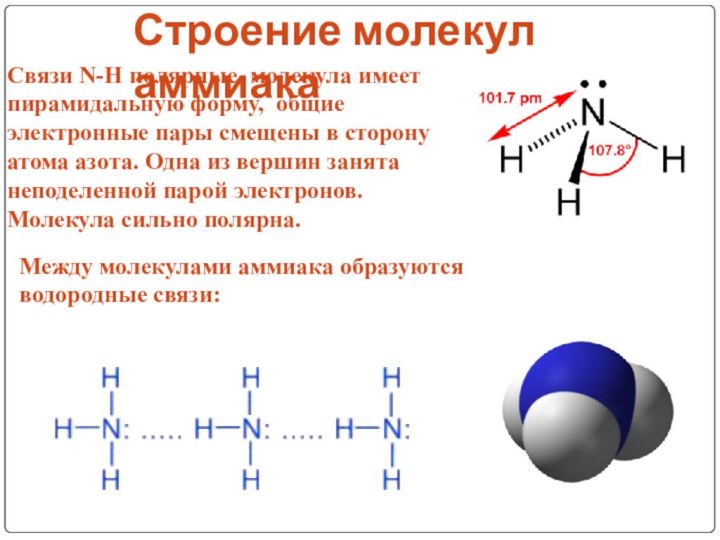
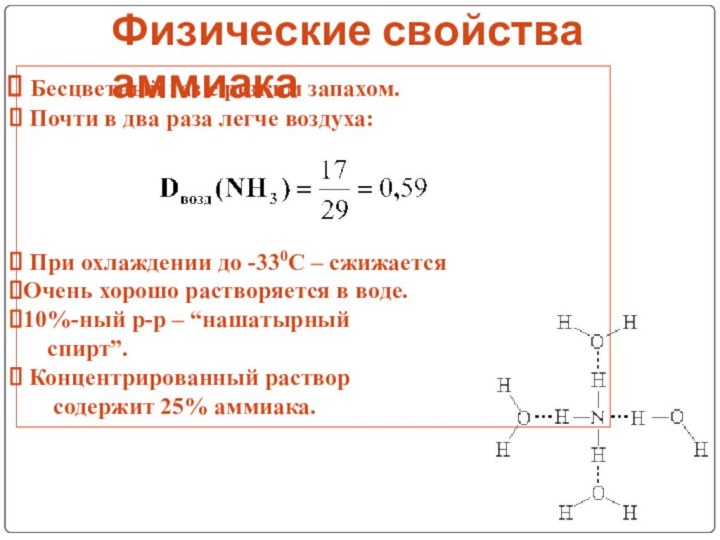
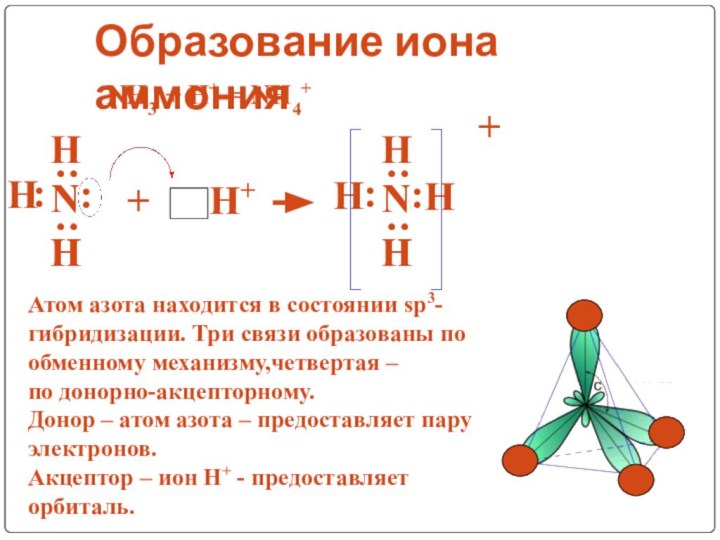
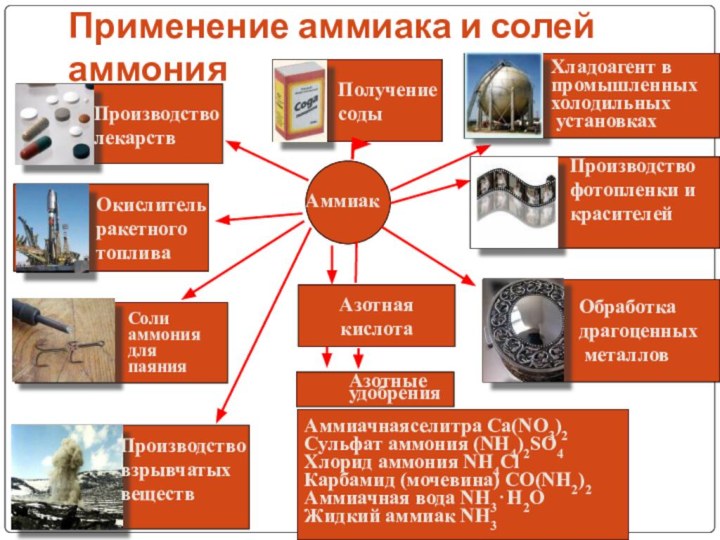
V группа
2s
2p
На внешнем уровне атома азота – валентные
1s-орбиталь,на которой находятся два спаренных электрона,
и три p-орбитали, на каждой из которых по одному
неспаренному электрону.