- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Лекция 6. Химическая кинетика
Содержание
- 2. Химическая кинетика - то раздел химии, изучающий скорость и механизм химических реакций.
- 3. 6.1 Понятие о скорости и механизме химических
- 4. Большинство биохимических реакций являются гомогенными (протекающими в
- 5. Средняя скорость гомогенной реакции (υ) равна изменению
- 6. [A]0_ и [A] – исходная и
- 7. Средняя скорость гетерогенной реакции, протекающей на границе
- 8. где ν0 и ν – количество вещества
- 9. Чтобы произошла химическая реакция, необходимо взаимодействие между
- 11. Во всем многообразии столкновений выделяют элементарные стадии
- 12. Характеристикой элементарной стадии является ее молекулярность, т.е.
- 13. Механизм химической реакции – это число и последовательность элементарных стадий процесса.
- 14. Химические реакциипростые по механизму представляет собой многократное
- 15. 6.2 Уравнения, описывающие влияние концентрации реагирующих веществ на скорость химических реакций, называются кинетическими уравнениями.
- 16. Кинетические уравнения составляют на основе закона действующих
- 17. Математическое выражение ЗДМ для реакции:аА + bВ
- 18. k зависит от температуры и природы веществ
- 19. Порядок реакции определяется только экспериментально. Он является
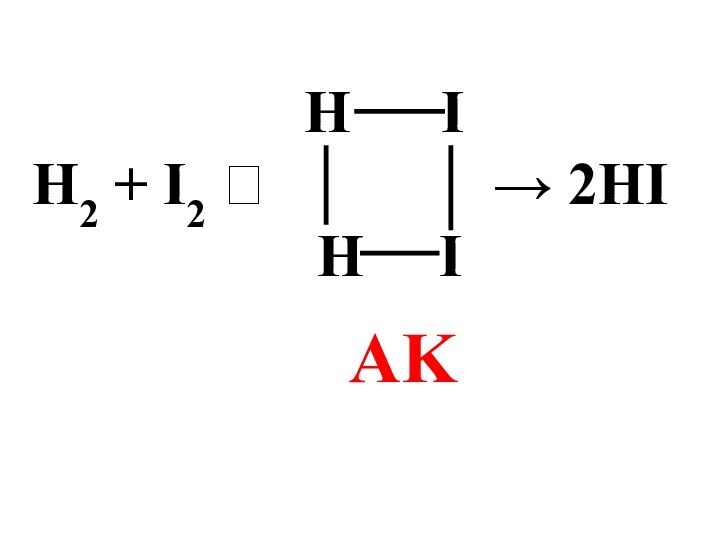
- 20. Только для простых реакций порядок и молекулярность совпадают:H2 + I2 → 2HIυ = k [H2][I2]
- 21. Кинетическое описание простых реакций.Реакции нулевого порядка (n=0)Примеры: фотохимические, каталитические и ферментативные реакции (при высокой концентрации субстрата).
- 22. Условное уравнение:Константаскорости
- 23. [A]Кинетическая кривая реакций нулевого порядкаυ
- 24. Время полуреакции (τ ½) –это время, необходимое
- 25. Реакции первого порядка (n=1)Примеры: каталитические и ферментативные
- 26. Условное уравнение:Константаскорости
- 27. Кинетическая кривая реакции первого порядка[A]υ
- 28. Время полуреакции:τ ½ =ℓn 2k
- 29. Кинетика сложных реакций1) обратимые реакцииA
- 30. ABCk1k2KClO32) Параллельные реакцииKCl + O2KCl + KClO4Кинетическое
- 31. Скорость реакции равна скорости ее лимитирующей стадии:
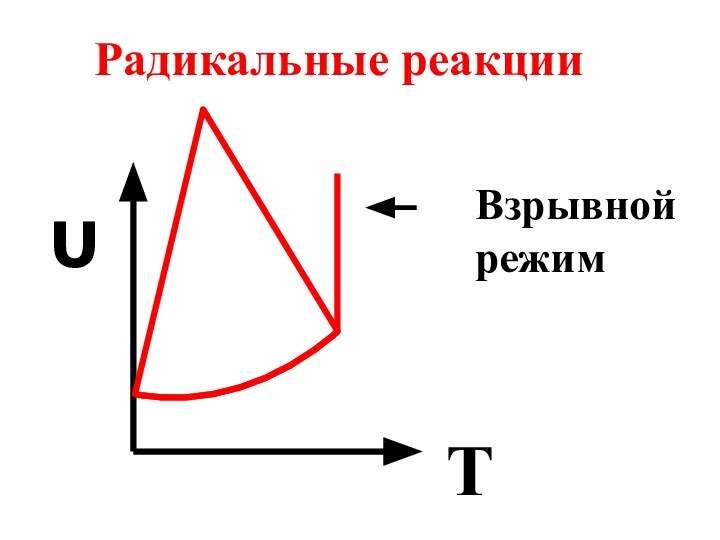
- 32. υT 6.3 Влияние температуры на скорость может быть различным. Скорость тримолекулярных реакций с ростом температуры уменьшается
- 33. υTВзрывной режим Радикальные реакции
- 34. Ферментативные реакцииυT600C
- 35. Для большинства химических реакций выполняется правило Вант-Гоффа:при
- 36. υT2=υT1γT2 – T110где Т1 и Т2 -
- 37. Значительно точнее зависимость скорости и температуры описывается уравнением Аррениуса: -Еак/RTυ = υ 0ek = k0e-Еак/RT
- 38. где υ0 и k0 - коэффициенты пропорциональности, называемые предэкспоненциальными множителями,Еак - энергия активации, кДж/моль.
- 39. С точки зрения теории активного комплекса, энергия
- 40. Активный комплекс- промежуточная частица, в которой старые
- 41. Схема химической реакции :А + В А...В РА...В - активный комплекс
- 43. Энергетическая диаграмма экзотермической реакцииA … BPA+BEaкКоордината реакцииЭнергия, кДж/моль
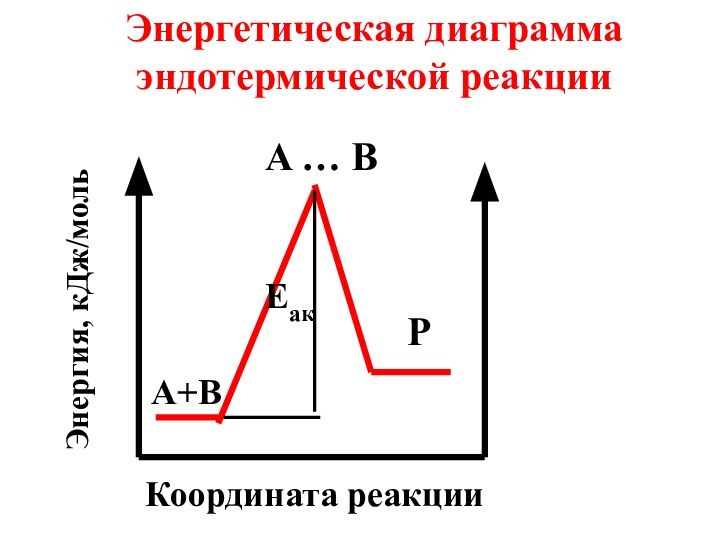
- 44. Энергетическая диаграмма эндотермической реакцииA … BPA+BEaкКоордината реакцииЭнергия, кДж/моль
- 45. Энергия активации (Еак) зависит от природы реагирующих веществ и не зависит от температуры.
- 46. С повышением температуры в реакционной смеси возрастает
- 47. 6.4 Катализаторы – это вещества, изменяющие скорость
- 48. С точки зрения теории активного комплекса механизм
- 49. Координата реакцииПоложительный катализатор снижает энергетический барьер реакцииЭнергия, кДж/мольБез катали-затораС положи-тельным катализато-ром
- 50. Под воздействием положи-тельного катализатора в реакционной смеси
- 51. Координата реакцииОтрицательный катализатор повышает энергетический барьер реакцииЭнергия, кДж/мольБез катали-затораС отрица-тельным ка-тализатором
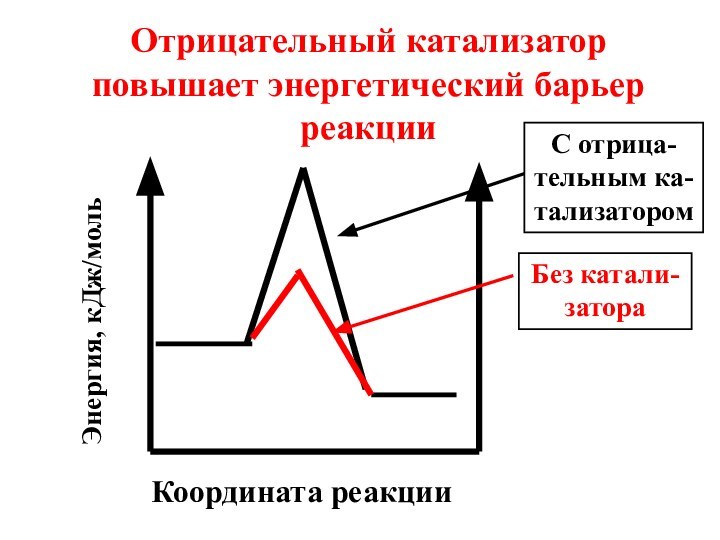
- 52. Под воздействием отрицательного катализатора в реакционной смеси
- 53. Практически все биохимические реакции являются ферментативными. Фермен-ты
- 54. Ферменты отличаются от обычных катализаторов:а) более высокой каталитической активностью;б) высокой специфичностью, т.е. избирательностью действия.
- 55. Механизм односубстратной ферментативной реакции можно представить схемой:P+KMk2Лимитирующая стадия
- 56. Е –
- 57. Характеристикой первой стадии ферментативной реакции является КМ
- 58. KMKM = 10‾5–10‾3 моль/л Чем меньше КМ, тем устойчивее комплекс .
- 59. Кинетическое уравнение ферментативной реакции:υ = k2 [ES],
- 60. k2 равна числу молекул субстрата, превращающихся в
- 61. Из-за невозможности экспериментального определения [ES], уравнение (1) преобразовали, выразив [ES] через легко измеряемые параметры реакции.
- 62. υ =[E]общ [S]KM + [S]k2 Кинетическое уравнение ферментативных реакций (уравнение Михаэлиса-Ментен) 1913
- 63. Произведение k2×[E]общ является величиной постоянной, которую обозначают υmax (максимальная скорость) υ =υmax [S] KM + [S]
- 64. При низкой концентрации субстрата KM >> [S], поэтомуυ =υmaxKM[S]Кинетическое уравнение реакции 1-го порядка
- 65. 2) При высокой концентрации субстрата Км
- 66. Кинетическая кривая ферментативной реакции[S]υРеакция нулевого порядкаРеакция первого порядка
- 67. На активность ферментов оказывают влияние:а) температура,б) кислотность среды, в) наличие ингибиторов
- 68. pHрНоптВлияние кислотности растворов на активность ферментовk2
- 69. Ингибиторы ферментов – это вещества, занимающие часть
- 70. В роли ингибиторов выступают катионы тяжелых металлов, органические кислоты и другие соединения.
- 71. Скачать презентацию
- 72. Похожие презентации
Химическая кинетика - то раздел химии, изучающий скорость и механизм химических реакций.





![Лекция 6. Химическая кинетика [A]0_ и [A] – исходная и конечная концентрация вещества, моль/лτ -](/img/tmb/15/1465449/9ccded49831a8ed7431c3ac555272dc4-720x.jpg)













![Лекция 6. Химическая кинетика Только для простых реакций порядок и молекулярность совпадают:H2 + I2 → 2HIυ = k [H2][I2]](/img/tmb/15/1465449/7bcc5a51b063dde2a35f495c8fd9796d-720x.jpg)

![Лекция 6. Химическая кинетика Условное уравнение:Константаскорости [A]0 -](/img/tmb/15/1465449/da10af0b0dbc27dda9ca082adc0564b6-720x.jpg)
![Лекция 6. Химическая кинетика [A]Кинетическая кривая реакций нулевого порядкаυ](/img/tmb/15/1465449/f8c7945c55de4bf0047ab043cc174c85-720x.jpg)



![Лекция 6. Химическая кинетика Кинетическая кривая реакции первого порядка[A]υ](/img/tmb/15/1465449/65381699f9e02da0a2ff127b92aa06a9-720x.jpg)


![Лекция 6. Химическая кинетика ABCk1k2KClO32) Параллельные реакцииKCl + O2KCl + KClO4Кинетическое уравнение:υ = k1 ([A]0 –](/img/tmb/15/1465449/a19ad54b7e1b153833854a083b419c37-720x.jpg)
![Лекция 6. Химическая кинетика Скорость реакции равна скорости ее лимитирующей стадии: υ = k2 [B]3)](/img/tmb/15/1465449/f3f7bb462f89bf15b475f2c8da493d5a-720x.jpg)























![Лекция 6. Химическая кинетика Кинетическое уравнение ферментативной реакции:υ = k2 [ES], (1)где k2](/img/tmb/15/1465449/fe629705121c375bd702d33e2b2097a4-720x.jpg)

![Лекция 6. Химическая кинетика Из-за невозможности экспериментального определения [ES], уравнение (1) преобразовали, выразив [ES] через легко измеряемые параметры реакции.](/img/tmb/15/1465449/ee1fe7939d2942919bcc57a0a918c65b-720x.jpg)
![Лекция 6. Химическая кинетика υ =[E]общ [S]KM + [S]k2 Кинетическое уравнение ферментативных реакций (уравнение Михаэлиса-Ментен) 1913](/img/tmb/15/1465449/23f7624f464e21d46198c4de3d9fa174-720x.jpg)
![Лекция 6. Химическая кинетика Произведение k2×[E]общ является величиной постоянной, которую обозначают υmax (максимальная скорость) υ =υmax [S] KM + [S]](/img/tmb/15/1465449/f33a052bb98dbdda209ec4e49a27593d-720x.jpg)
![Лекция 6. Химическая кинетика При низкой концентрации субстрата KM >> [S], поэтомуυ =υmaxKM[S]Кинетическое уравнение реакции 1-го порядка](/img/tmb/15/1465449/3cff27e416e500811046455a5024abd4-720x.jpg)

![Лекция 6. Химическая кинетика Кинетическая кривая ферментативной реакции[S]υРеакция нулевого порядкаРеакция первого порядка](/img/tmb/15/1465449/9c78f40cac46bf80a60530b309a2eb7d-720x.jpg)





Слайд 3
6.1 Понятие о скорости и механизме химических реакций.
6.2
Влияние концентрации реагирующих веществ на скорость химических реакций.
6.3
Влияние температуры на скорость химических реакций. 6.4 Ферментативный катализ
План
Слайд 4 Большинство биохимических реакций являются гомогенными (протекающими в одной
фазе). Они могут быть как быстрыми (реакции, лежащие в
основе передачи нервного импульса, протекают практически мгновенно), так и медленными (время обновления белков на половину составляет 70 дней).Слайд 5 Средняя скорость гомогенной реакции (υ) равна изменению концентрации
вещества в единицу времени:
υ =
[A] - [A]0
τСлайд 6 [A]0_ и [A] – исходная и конечная
концентрация вещества, моль/л
τ - время реакции, с., мин.,
(+) –
вещество образуется,(–) – вещество расходуется.
Слайд 7 Средняя скорость гетерогенной реакции, протекающей на границе раздела
фаз, равна изменению количества вещества в единицу времени на
единице площади поверхности раздела фаз:υ =
ν - ν0 S ×τ
Полное обновление костной ткани составляет от 4 до 7 лет.
Слайд 8 где ν0 и ν – количество вещества в
начальный и конечный момент времени, моль
S – площадь поверхности
раздела фаз, м2Слайд 9 Чтобы произошла химическая реакция, необходимо взаимодействие между молекулами
реагирующих веществ. Это взаимодействие происходит в форме столкновения
молекул.Слайд 11 Во всем многообразии столкновений выделяют элементарные стадии процесса.
Элементарная стадия – это столкновение молекул реагирующих веществ, приводящее
к образованию молекул продуктов.Слайд 12 Характеристикой элементарной стадии является ее молекулярность, т.е. число
участвующих в ней частиц. Стадии могут быть:
мономолекулярными I2
→ 2Iбимолекулярными Н2 + I2 → 2HI
тримолекулярными 2NO + O2 → 2NO2
Слайд 14
Химические реакции
простые по механизму представляет собой многократное чередование
одной элементарной стадии
сложные по механизму протекают в несколько элементарных
стадийСлайд 15 6.2 Уравнения, описывающие влияние концентрации реагирующих веществ на
скорость химических реакций, называются кинетическими уравнениями.
Слайд 16 Кинетические уравнения составляют на основе закона действующих масс
(Гульдберг и Вааге,1867): скорость химических реакций прямо пропорциональна произведению
концентраций реагирующих веществ, возведенных в некоторые показатели степени.
Слайд 17
Математическое выражение ЗДМ для реакции:
аА + bВ +
cС → Р
υ = k [A]x [B]y [C]z
где k
– константа скорости, являющаяся фундаментальной кинетической характеристикой реакций.Слайд 18 k зависит от температуры и природы веществ и
не зависти от их концентрации;
[A], [B], [C] – концентрации
реагирующих веществ, моль/л;x, y и z – порядок реакции по веществам.
Общий порядок реакции (n) равен: n = x + y + z
Слайд 19 Порядок реакции определяется только экспериментально. Он является величиной
формальной и может принимать любые значения: положительные, отрицательные, целые
, дробные, а также 0.
Слайд 21
Кинетическое описание простых реакций.
Реакции нулевого порядка (n=0)
Примеры: фотохимические,
каталитические и ферментативные реакции (при высокой концентрации субстрата).
Слайд 22
Условное уравнение:
Константа
скорости
[A]0 - [A]
k =
τА → Р
Кинетическое уравнение:
υ = k [A]0= k
Слайд 24 Время полуреакции (τ ½) –это время, необходимое для
уменьшения концентрации исходного вещества в два раза.
[A]0τ ½ =
2k
Слайд 25
Реакции первого порядка (n=1)
Примеры: каталитические и ферментативные реакции
(при низкой концентрации субстрата), радиоактивный распад, выведение лекарственных препаратов
из организма человека.
Слайд 29
Кинетика сложных реакций
1) обратимые реакции
A
B
k1
k2
Кинетическое уравнение:
υ = k1[A] –
k2[B]
Слайд 30
A
B
C
k1
k2
KClO3
2) Параллельные реакции
KCl + O2
KCl + KClO4
Кинетическое уравнение:
υ
= k1 ([A]0 – [B]) + k2 ([A]0 –
[C])
Слайд 31
Скорость реакции равна скорости ее лимитирующей стадии:
υ = k2 [B]
3) Последовательные реакции
A B
Ck1
k2
быстрая
медленная
(лимитирующая)
Слайд 32
υ
T
6.3 Влияние температуры на скорость может быть
различным. Скорость тримолекулярных реакций с ростом температуры уменьшается
Слайд 35
Для большинства химических реакций выполняется правило Вант-Гоффа:
при повышении
температуры на каждые 10 градусов скорость реакции возрастает в
2-4 раза.T
υ
Слайд 36
υT
2
=
υT
1
γ
T2 – T1
10
где Т1 и Т2 - начальная
и конечная температура,
- температурный коэффициент реакции
2 < γ
< 4Слайд 37 Значительно точнее зависимость скорости и температуры описывается уравнением
Аррениуса:
-Еак/RT
υ = υ 0e
k = k0e
-Еак/RT
Слайд 38 где υ0 и k0 - коэффициенты пропорциональности, называемые
предэкспоненциальными множителями,
Еак - энергия активации, кДж/моль.
Слайд 39 С точки зрения теории активного комплекса, энергия активации
(энергетический барьер химической реакции) - это энергия образования активного
комплекса из реагирующих веществ.
Слайд 40
Активный комплекс
- промежуточная частица, в которой старые связи
еще не полностью разорвались, а новые - не полностью
образовались.
Слайд 43
Энергетическая диаграмма экзотермической реакции
A … B
P
A+B
Eaк
Координата реакции
Энергия, кДж/моль
Слайд 44
Энергетическая диаграмма эндотермической реакции
A … B
P
A+B
Eaк
Координата реакции
Энергия, кДж/моль
Слайд 45 Энергия активации (Еак) зависит от природы реагирующих веществ
и не зависит от температуры.
Слайд 46 С повышением температуры в реакционной смеси возрастает доля
активных молекул, способных преодолеть энергетический барьер химической реакции, что
приводит к увеличению ее скорости.Слайд 47 6.4 Катализаторы – это вещества, изменяющие скорость химической
реакции, но не изменяющиеся в ходе процесса ни качественно,
ни количественно. Они не входят в состав продуктов реакции.Слайд 48 С точки зрения теории активного комплекса механизм действия
катализаторов в том, что они изменяют высоту энергетического барьера
химической реакции.
Слайд 49
Координата реакции
Положительный катализатор снижает энергетический барьер реакции
Энергия, кДж/моль
Без
катали-затора
С положи-тельным катализато-ром
Слайд 50 Под воздействием положи-тельного катализатора в реакционной смеси возрастает
доля активных молекул при данной температуре.
Скорость реакции увеличивается.
Слайд 51
Координата реакции
Отрицательный катализатор повышает энергетический барьер реакции
Энергия, кДж/моль
Без
катали-затора
С отрица-тельным ка-тализатором
Слайд 52 Под воздействием отрицательного катализатора в реакционной смеси снижается
доля активных молекул при данной температуре. Скорость реакции уменьшается.
Слайд 53 Практически все биохимические реакции являются ферментативными. Фермен-ты (биокатализаторы)
– это вещества белковой природы, активированные катионами металлов.
Слайд 54
Ферменты отличаются от обычных катализаторов:
а) более высокой каталитической
активностью;
б) высокой специфичностью, т.е. избирательностью действия.
Слайд 55
Механизм односубстратной ферментативной реакции можно представить схемой:
P+
KM
k2
Лимитирующая стадия
Слайд 57 Характеристикой первой стадии ферментативной реакции является КМ –
константа Михаэлиса. КМ является величиной, обратной
константе равновесия.
Слайд 59
Кинетическое уравнение ферментативной реакции:
υ = k2 [ES],
(1)
где k2 – константа скорости, называемая числом
оборотов или молекулярной активностью фермента. Слайд 60 k2 равна числу молекул субстрата, превращающихся в продукт
под воздействием одной молекулы фермента за 1 минуту при
250С1×104 < k2 < 6×106 мин‾1





























