Слайд 2
Что такое металлы?
Металлы — группа элементов, в виде
простых веществ обладающих характерными металлическими свойствами, такими как высокие
тепло- и электропроводность, высокая пластичность и металлический блеск
У атомов металлов на внешнем энергетическом уровне обычно 1-3 электрона. Их атомы обладают большим радиусом и легко отдают валентные электроны, т.е. проявляют восстановительные свойства.
Слайд 3
Положение металлов в ПСХЭ, изменение металлических свойств в
группах и периодах
Металлы располагаются в основном в левой и
нижней части ПСХЭ;
В периоде с возрастанием заряда ядра атома (слева направо) металлические свойства ослабевают, т. к. увеличивается число электронов на последнем слое. В подгруппе с возрастанием заряда ядра (сверху вниз) металлические свойства усиливаются, т. к. увеличивается радиус атома и отдавать электроны становится легче.
Слайд 4
Нахождение металлов в природе
в самородном состоянии: серебро ,
золото , платина , медь , иногда ртуть (благородные
металлы)
в виде оксидов и сульфидов: магнетит Fe3O4, гематит Fe2О3, галенит PbS, киноварь НgS и другие (металлы средней активности)
в виде смешанных оксидов: каолин Аl2O3· 2SiO2 • 2Н2О, алунит (Na,K)2O • Al2O3 • 2SiO2 и другие
в виде солей: хлоридов: сильвин КСl, галит NaCl, сильвинит КСl· NаСl, карналлит КСl • МgСl2 • 6Н2О, сульфатов: барит ВаSO4, фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3 (активные металлы)
Слайд 5
Нахождение металлов в природе
Многие металлы часто сопутствуют основным
природным минералам: скандий входит в состав оловянных, вольфрамовых руд,
кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
содержание некоторых металлов в земной коре
алюминий — 8,2%
железо — 4,1%
кальций — 4,1%
натрий — 2,3%
магний — 2,3%
калий - 2,1 %
титана— 0,56%
Слайд 6
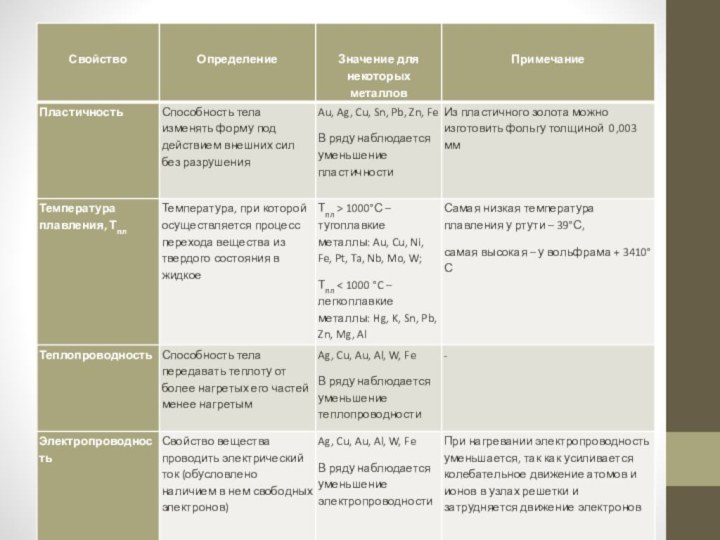
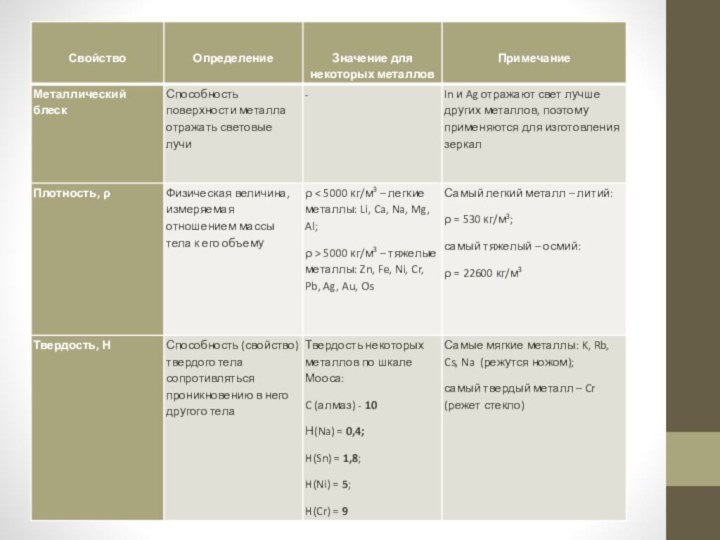
Физические свойства металлов
Физические свойства металлов обусловлены наличием в
них металлической связи.
Металлическая связь – это связь, которую осуществляют
свободные электроны между катионами и свободными атомами в металлической кристаллической решётке
Слайд 9
Способы получения металлов
1. Пирометаллургия – восстановление металлов из руд
при высоких температурах с помощью углерода, оксида углерода (II),
водорода (водородотермия), алюминия (алюминотермия):
Cu2O + C = 2Cu + CO
Fе2О3 + ЗСО = 2Fе + ЗСО2
WO3 + 3H2 =W + 3H2O (получают особо чистые металлы)
4Аl + ЗМnО2 = 2А12О3 + ЗМn (получают менее активные металлы, чем Al)
2. Гидрометаллургия – восстановление металлов из солей в растворе
CuO + H2SO4 = CuSO4 + H2O,
CuSO4 + Fe = Cu + FeSO4.
Слайд 10
Способы получения металлов
3. Обжиг сульфидов металлов и последующим
восстановлением образовавшихся оксидов
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО +
С = СО + Zn
4. Электролиз расплавов солей
2NaCl ⟶ 2Na + Cl2
Kатод – восстановление (-) Na+ + еˉ = Na,
Aнод – окисление (+) 2Cl- -2 еˉ = Cl2
5. Электролиз растворов солей
2CuSO4 + 2H2O ⟶ 2Cu + O2 + 2H2SO4
Слайд 11
Химические свойства металлов
Чем левее стоит металл в ряду
напряжений , тем более сильным восстановителем он является, самый
сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них (исключение азотная кислота)
Слайд 12
Химические свойства металлов
Взаимодействие с простыми веществами
4Al + 3O2 =
2Al2O3
Cu + Cl2 = CuCl2
2Na + H2 = 2NaH
Zn + S
= ZnS
3Mg + N2 = Mg3N2
4Al + 3C = Al3C4
3Ca + 2P = Ca3P2
Слайд 13
Химические свойства металлов
Взаимодействие со сложными веществами
1)С кислотами
2Al +
6HCl = 2AlCl3+3H2
Zn + H2SO4 = ZnSO4 + H2↑
Cu + 4HNO3 =
Cu(NO3)2 + 2NO2 + 2H2O
Cu + H2SO4 ≠
2) С водой
2Na + 2H2O = 2NaOH+ H2
3Fe + 4H2O = Fe3O4 + 4H2
3) С солями менее активных металлов
Zn + CuCl2 = ZnCl2 + Cu