Слайд 2
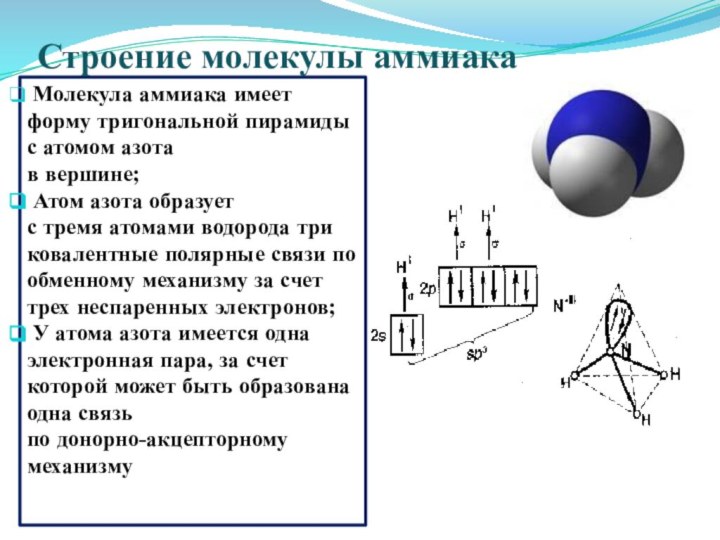
Строение молекулы аммиака
Молекула аммиака имеет форму тригональной
пирамиды с атомом азота
в вершине;
Атом азота
образует
с тремя атомами водорода три ковалентные полярные связи по обменному механизму за счет трех неспаренных электронов;
У атома азота имеется одна электронная пара, за счет которой может быть образована одна связь
по донорно-акцепторному механизму
Слайд 3
Химические свойства аммиака
Уравнения химических реакций взаимодействия :
аммиака с
водой,
газообразного аммиака с газообразным хлороводородом,
раствора аммиака с
растворами кислот,
Раствора аммиака с растворами солей – хлоридом алюминия и хлоридом цинка – реакции обмена,
Раствора аммиака с раствором сульфата меди (II) – реакция обмена и комплексообразования .
Слайд 4
Аммиак − слабое основание
Аммиак − это слабое основание,
водные растворы аммиака имеют
слабощелочную среду и окрашивают растворы индикатора:
лакмуса
– в синий цвет;
метилового оранжевого – в желтый цвет;
фенолфталеина – в малиновый цвет
NH3 + H2O ⇌ NH3•H3O ⇌ NH4OH ⇌ NH41+ + OH1−
гидрат аммиака гидроксид аммония
Водный раствор аммиака – слабое основание
Механизм образования катиона аммония:
Электронная пара атома азота (донор) NH3 взаимодействует
с вакантной электронной орбиталью протона водорода □H1+ (акцептор):
: NH3 + □H1+→ [NH4]1+
:
Слайд 5
Взаимодействие аммиака с хлороводородом
и раствором соляной кислоты
:
2. При взаимодействии:
а) газообразного аммиака с газообразным хлороводородом образуется
твердый мелкокристаллический хлорид аммония
NH3(газ) + HCI(газ) → NH4CI (твердый хлорид аммония)
б) раствора аммиака с раствором соляной кислоты происходит образование раствора хлорида аммония:
NH3(раствор) + HCI(раствор) → NH4CI (раствор)
Слайд 6
Взаимодействие раствора аммиака
с растворами кислот :
3. Аммиак
взаимодействует с кислотами, образуя соли аммония:
а) с серной кислотой
− сульфат или гидросульфат аммония:
2NH3 + H2SO4 →(NH4)2SO4 сульфат аммония
NH3 + H2SO4 → NH4НSO4 гидросульфат аммония
б) с азотной кислотой − нитрат аммония:
NH3 + HNO3 → NH4NO3
Слайд 7
Взаимодействие раствора аммиака
с растворами солей
4. Аммиака или
гидроксид аммония реагирует
с растворами солей, образуя нерастворимые основания
или нерастворимые амфотерные гидроксиды:
а) 6NH3•Н2О + Al2(SO4)3 → 3(NH4)2SO4 + 2 Al(OH)3↓ гидроксид алюминия
б) 2NH3•Н2О + Zn(NO3)2→ 2NH4NO3 + Zn(OH)2↓
гидроксид цинка
Слайд 8
Взаимодействие аммиака с соединениями
меди (II) и другими
солями
5. Комлексообразование – молекулы NH3 могут входить в качестве
лиганда в комплексные соединения, благодаря своим электронодонорным свойствам.
Введение избытка аммиака в растворы солей приводит
к образованию их амминокомплексов:
CuSO4 + 4NH3 → [Cu(NH3)4]SO4 − изменение окраски раствора с голубой на ярко-синюю
Cu(ОН)2 + 4NH3 → [Cu(NH3)4](ОН)2 – растворение осадка голубого цвета, образование прозрачного ярко-синего раствора
Ni(NO3)2 + 6NH3 → [Ni(NH3)6](NO3)2 − изменение окраски раствора с зеленой на сине-фиолетовую
Слайд 9
Аммиак – сильный восстановитель :
Так как в аммиаке
атом N−3 находится в низшей степени окисления, то аммиак
проявляет свойства сильного восстановителя
Слайд 10
Свойства аммиака как восстановителя
1. Взаимодействие с галогенами:
а) Фтор
мгновенно окисляет аммиак до трифторида:
N–3H3 + 3F2 → N+3F3
+ 3HF;
б) Хлор окисляет аммиак до свободного азота:
2N–3H3 + 3Cl2 →N20 + 6HCl
8N–3H3 + 3Cl2 → N20 + 6N–3H4Cl (при избытке аммиака образуется
не хлороводород, а хлорид аммония)
в) Бром также окисляет аммиак до свободного азота:
2N–3H3 + 3Br2 → N20 + 6HBr
8N–3H3 + 3Br2 → N20 + 6N–3H4Br
2. Взаимодействие с кислородом:
а) аммиак в кислороде горит зеленовато-желтым пламенем:
4N–3H3 + 3O2 → 2 N20 + 6H2O
б) каталитическое окисление
t°C, Pt
4N–3H3 + 5O2 → 4N+2O + 6H2O
3. Восстановление металлов из оксидов
2N–3H3 + 3Cu+2O = N20 + 3Cu0 + 3H2O
Слайд 11
Методы получения аммиака
Промышленные методы получения аммиака;
Лабораторные методы получения
аммиака и фосфина
Слайд 12
Промышленный метод получения аммиака
Прямое взаимодействие водорода и азота
(процесс Габера):
р=200 атм
N2(г) + 3H2(г) ⇌ 2NH3(г) + 91,84 кДж
400°C, Fe
Катализатор: пористое железо с примесями Al2O3, K2O
Слайд 13
Лабораторные методы получения
Аммиака
Фосфина
1. Взаимодействие солей аммония со
щелочами
при нагревании:
Ca(OH)2 + 2NH4Cl →
→ CaCl2 +
2H2O + 2NH3↑
2. Гидролиз нитридов металлов:
Mg3N2 + 3H2О →
→ 3Mg(ОН)2↓ + 2NH3↑
1. Взаимодействии белого фосфора с горячей щёлочью:
2P4 + 3Ca(OH)2 + 6H2O → 2PH3↑ + +3Ca(H2PO4)2
2. Гидролиз фосфидов металлов:
Mg3P2 + 3H2О →
→ 3Mg(ОН)2↓ + 2PH3↑
Слайд 14
СОЛИ АММОНИЯ :
Все соли аммония при нагревании
разлагаются;
При этом возможны:
1) Не ОВР процессы – для галогенидов,
сульфидов, карбонатов, сульфатов, фосфатов;
2) ОВР процессы – для сульфитов, нитратов, нитритов, бихроматов
Слайд 15
Получение и термолиз солей аммония (не ОВР)
Получение
Термолиз(разложение)
1.1. Карбонат
аммония
2NН3+ СО2 + Н2О → (NН4)2СО3
1.2. Гидрокарбонат аммония
NН3 +
СО2 + Н2О → NН4НСО3
1.3. Галогениды аммония
NН3 + НHal → NН4Hal
НHal = HF, HCl, HBr, HI
1.4. Сульфид аммония
H2Sгаз + 2NH3р-р = (NH4)2Sр-р
1.5. Гидросульфид аммония
H2Sгаз + NH3р-р = NH4НSр-р
1.1. Карбонат аммония
t°C
(NН4)2СО3 → 2NН3↑+ СО2↑ + Н2О
1.2. Гидрокарбонат аммония
t°C
NН4НСО3 → NН3↑+ СО2↑ + Н2О
1.3. Галогениды аммония
t°C
NН4Hal →NН3↑ + НHal↑
НHal = HF, HCl, HBr, HI
1.4. Сульфид аммония
t°C
(NH4)2S →2NН3↑ + H2S↑
1.5. Гидросульфид аммония
t°C
NH4НS →NН3↑ + H2S↑
Слайд 16
Получение и термолиз солей аммония (не ОВР)
Получение
Термолиз
1.6. Сульфат
аммония
2NH3 + H2SO4 → (NH4)2SO4
1.7. Гидросульфат аммония
NH3 + H2SO4
→ NH4НSO4
1.8. Гидрофосфат аммония
2NH3 + H3РO4 → (NH4)2НРO4
1.9. Дигидрофосфат аммония
NH3 + H3РO4 → NH4Н2РO4
1.6. Сульфат аммония
t°C
(NH4)2SO4 → NН3↑ + NH4НSO4
1.7. Гидросульфат аммония
t°C > 500°C
NH4НSO4 → NН3↑ + SО3 + Н2О
1.8. Гидрофосфат аммония
t°C
(NH4)2НРO4 → NН3↑ + NH4Н2РO4
1.9. Дигидрофосфат аммония
t°C
NH4Н2РO4 → NН3↑ + Н3РO4
Слайд 17
Получение и термолиз солей аммония (ОВР)
Получение
Термолиз
2.1. Нитрит аммония
Поглощение
смеси газообразных окислов NO и NO2 водным раствором аммиака
2NН3р-р+
NО2 + NO + H2O→
→ 2NН4NО2
2.2. Нитрат аммония
NН3 + НNО3 → NН4NО3
2.3. Бихромат аммония
2NН3 + H2O + CrO3 →(NН4)2Cr2O7
2.4. Сульфит аммония
2NН3р-р+ SО2 + H2O → (NH4)2SO3
2.1. Нитрит аммония
t°C
NН4NО2 → N2↑+ 2Н2О
2.2. Нитрат аммония
t°C
NН4NО3 → N2О↑+ 2Н2О
2.3. Бихромат аммония
t°C
(NН4)2Cr2O7 →
→ N2↑ + 4H2O↑ + Cr2O3
2.4. Сульфит аммония
t°C
4(NH4)2SO3 →
→ 3(NH4)2SO4 + 2NН3↑ + H2S↑
Слайд 18
Свойства солей аммония
Все соли аммония при нагревании взаимодействуют
со щелочами:
Ca(OH)2 + 2NH4Cl → CaCl2 + 2H2O
+ 2NH3↑
Все соли аммония гидролизуются по катиону
Слайд 19
1. Гидролиз солей аммония, образованных сильными кислотами
1.1. Галогениды
аммония (хлориды, бромиды, йодиды)
NH4Cl → NH41+ + Cl1−
NH41+ +
Н2O NH4OH + H1+ (гидролиз по катиону)
NH4Cl + Н2O NH4OH + HCl
рН < 7, среда – кислотная;
1.2. Нитрат аммония
NН4NО3 → NH41+ + NО31−
NH41+ + Н2O NH4OH + H1+ (гидролиз по катиону)
NН4NО3 + Н2O NH4OH + HNО3
рН < 7, среда – кислотная;
1.3. Сульфат аммония
(NH4)2SO4 → 2NH41+ + SO42−
NH41+ + Н2O NH4OH + H1+ (гидролиз по катиону)
(NH4)2SO4 + Н2O NH4OH + NH4НSO4
рН < 7, среда – кислотная
Слайд 20
2. Гидролиз солей аммония, образованных слабыми кислотами
2.1. Фторид
аммония
NH4F → NH41+ + F1−
NH41+ + Н2O NH4OH
+ H1+ (гидролиз по катиону)
F1− + Н2O HF + OH1− (гидролиз по аниону)
NH4F + Н2O NH4OH + HF
рН ≈ 7, среда – нейтральная;
2.2. Нитрит аммония
NН4NО2→ NH41+ + NО21−
NH41+ + Н2O NH4OH + H1+ (гидролиз по катиону)
NО21− + Н2O HNО2 + OH1− (гидролиз по аниону)
NН4NО2 + Н2O NH4OH + HNО2
рН ≈ 7, среда – нейтральная
Слайд 21
2. Гидролиз солей аммония, образованных слабыми кислотами
2.3. Сульфид
аммония
(NH4)2S → 2NH41+ + S2−
NH41+ + Н2O NH4OH
+ H1+ (гидролиз по катиону)
S2− + Н2O HS1− + OH1− (гидролиз по аниону)
(NH4)2S + Н2O NH4OH + NH4НS
рН ≥ 7, среда – слабощелочная;
2.4. Карбонат аммония
(NН4)2СО3 → 2NH41+ + СО32−
NH41+ + Н2O NH4OH + H1+ (гидролиз по катиону)
СО32− + Н2O HСО31− + OH1− (гидролиз по аниону)
(NН4)2СО3 + Н2O NH4OH + NН4НСО3
рН ≥ 7, среда – слабощелочная
Слайд 22
2. Гидролиз солей аммония, образованных слабыми кислотами
2.5. Сульфит
аммония
(NH4) 2SO3 → 2NH41+ + SO32−
NH41+ + Н2O
NH4OH + H1+ (гидролиз по катиону)
SO32− + Н2O HSO31− + OH1− (гидролиз по аниону)
(NH4) 2SO3 + H2O NH4OH + (NH4) НSO3
рН ≥ 7, среда – слабощелочная;
2.6. Гидросульфит аммония
NH4НSO3 → NH41+ + НSO31−
NH41+ + Н2O NH4OH + H1+ (гидролиз по катиону)
НSO31− + Н2O SО2↑ + H2O + OH1− (гидролиз по аниону)
NH4НSO3 + H2O NH4OH + SО2↑ + H2O
рН ≈ 7, среда – нейтральная;