- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Мини проект по химии: гидролиз
Содержание
- 2. определениеГидро́лиз (от др.-греч. ὕδωρ — вода и λύσις —
- 3. *Сольволиз — реакция обменного разложения между растворенным веществом
- 4. Степень гидролизаПод степенью гидролиза подразумевается отношение части
- 5. Константа гидролизаКонстанта гидролиза — константа равновесия* гидролитической реакции.
- 6. Гидролиз солей Взаимодействие ионов соли с водой,
- 7. Гидролиз солей Гидролиз соли сильной кислоты и
- 8. Применение процесса гидролизаОчень важное значение в промышленности
- 9. Перечисленные вещества имеют очень важное применение в
- 10. ссылкиhttp://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D0%BB%D1%8C%D0%B2%D0%BE%D0%BB%D0%B8%D0%B7http://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7http://images.yandex.ru/yandsearch?rpt=simage&img_url=www.mnepu.ru%2Ffl%2Fsite%2F658%2F355_o.jpg&ed=1&text=%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7&p=37http://files.school-collection.edu.ru/dlrstore/18fa472e-d890-67d3-166b-f8a59863c8a6/index.htmhttp://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D0%B0_%D1%80%D0%B0%D0%B2%D0%BD%D0%BE%D0%B2%D0%B5%D1%81%D0%B8%D1%8F
- 11. Скачать презентацию
- 12. Похожие презентации
определениеГидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза*, где при взаимодействии веществ с водой происходит разложение исходной молекулы с образованием новых соединений. Гидролизу подвергаются соединения различных классов: соли, углеводы, белки,










Слайд 3
*Сольволиз — реакция обменного разложения между растворенным веществом и
растворителем. Сольволиз в воде — гидролиз, сольволиз в аммиаке — аммонолиз,
сольволиз в спиртах — алкоголиз и т. д. В отличие от сольватации сольволиз приводит к образованию новых химических соединений определенного состава.В органической химии — особый тип нуклеофильного замещения, когда в роли нуклеофила выступает растворитель.
Слайд 4
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли,
подвергающейся гидролизу, к общей концентрации её ионов в растворе.
Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.Является количественной характеристикой гидролиза.
Слайд 5
Константа гидролиза
Константа гидролиза — константа равновесия* гидролитической реакции.
*Конста́нта
равнове́сия — величина, определяющая для данной химической реакции соотношение между
термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Слайд 6
Гидролиз солей
Взаимодействие ионов соли с водой, приводящее к
образованию молекул слабого электролита, называют гидролизом солей.
Различают несколько вариантов
гидролиза солей:
Слайд 7
Гидролиз солей
Гидролиз соли сильной кислоты и слабого основания:
CuCl2 + Н2О = CuOHCl + HCl
Cu + Н2О
= CuOH + Н(раствор имеет кислую среду, реакция протекает обратимо)
Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
2Al + 3S + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
(Гидролиз в этом случае протекает практически полностью,
так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
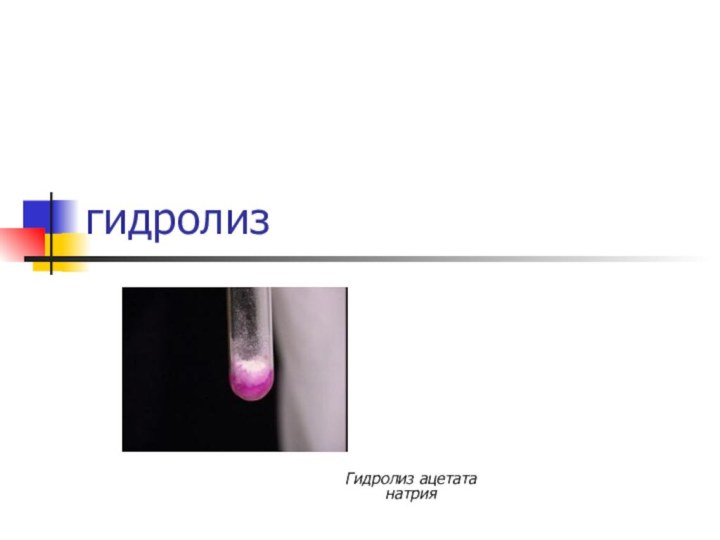
гидролиз
Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO3 + H2O = HCO + OH
(раствор имеет щелочную среду, реакция протекает обратимо
Соль сильной кислоты
и сильного основания
не подвергается
гидролизу, и раствор нейтрален
Слайд 8
Применение процесса гидролиза
Очень важное значение в промышленности основного
органического и нефтехимического синтеза имеет такой процесс, как гидролиз.
Применяя его в отношении жиров, целлюлозы и углеводов давно получают мыло, глицерин, этиловый спирт и другие ценные продукты. В области органического синтеза рассматриваемые операции используются главным образом для производства спиртов С2-С5, фенолов, простых эфиров, окисей, многих ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов), а также ацетальдегида и других соединений.
Слайд 9
Перечисленные вещества имеют очень важное применение в качестве
промежуточных продуктов органического синтеза, мономеров и фенолов, эфиров акриловой
и метакриловой кислот, меламинов, хлоролефинов, акрилонитрилов, пластификаторов и смазочных материалов. Также используют для растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов, поверхностно-активных веществ и т.д.Производство перечисленных выше продуктов имеет большие масштабы как у нас в стране, так и зарубежом.





























