случае необходимости произвести предварительный расчет;
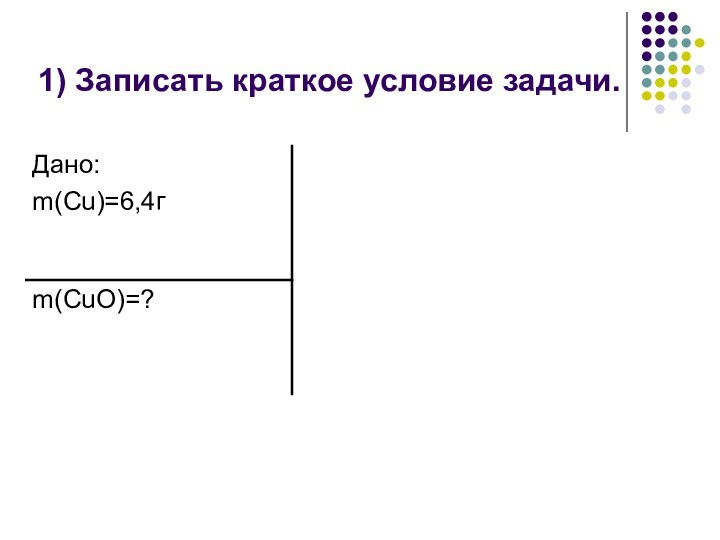
Перевести величины, данные в условии,
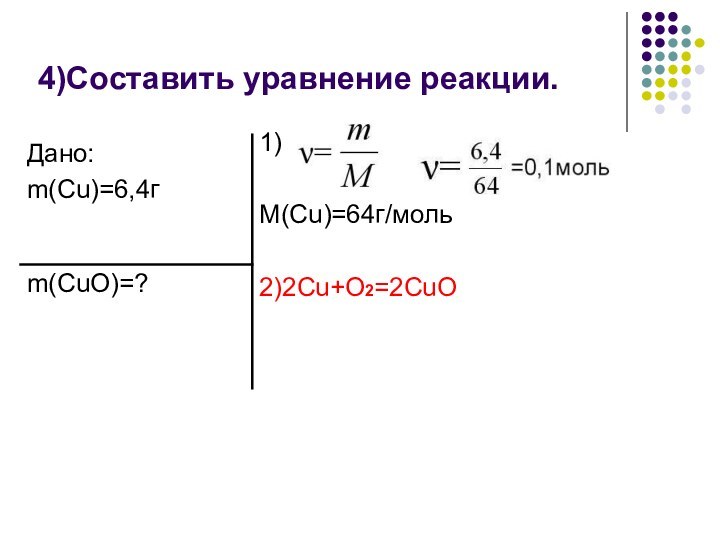
в моли;Составить уравнение реакции;
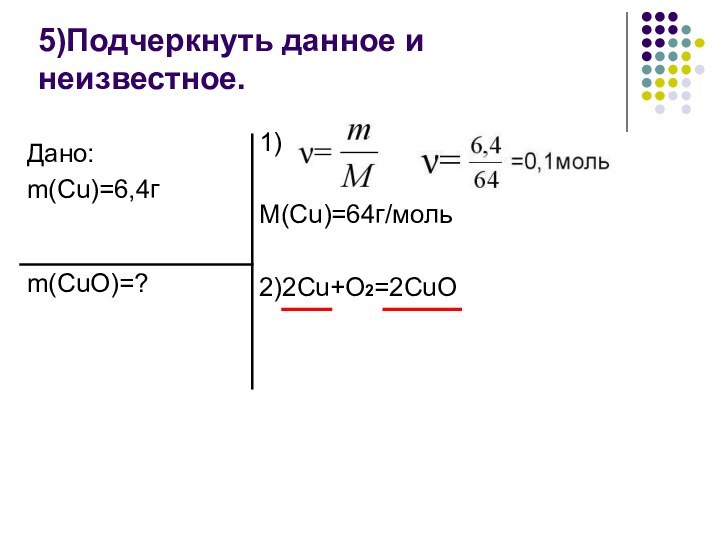
Подчеркнуть данное и неизвестное;
Записать известное и неизвестное над формулами тех веществ, к которым они относятся;
Подписать под формулами с учетом коэффициентов количества моль веществ;
Составить пропорцию, решить её;
Перевести полученное количество моль в те единицы, которые требуются в условии задачи;
Записать ответ.