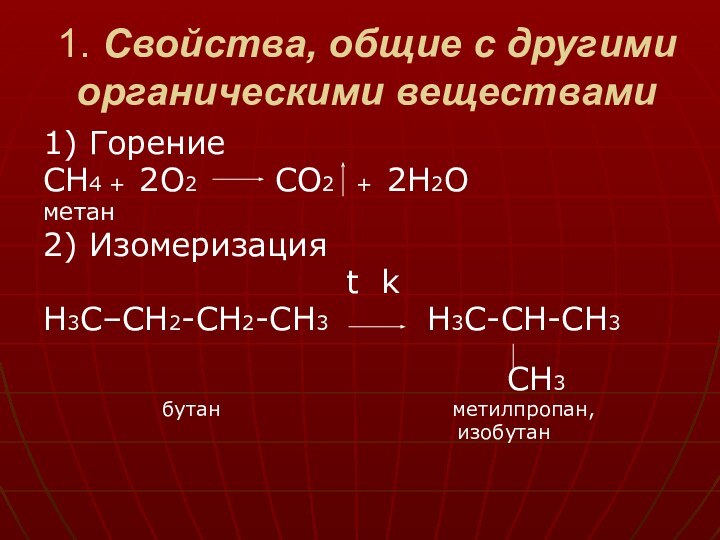
насыщеные углеводороды, то для них не характерны реакции присоединения,
а только реакции замещения.Так как все связи в алканах ковалентные ( очень прочные ), тяжело разрываются, то реакции замещения идут очень тяжело ( t; свет ).
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






















свет
метан
хлорметан
свет
свет
свет
дихлорметан
трихлорметан
тетрахлорметан
свет
бутан
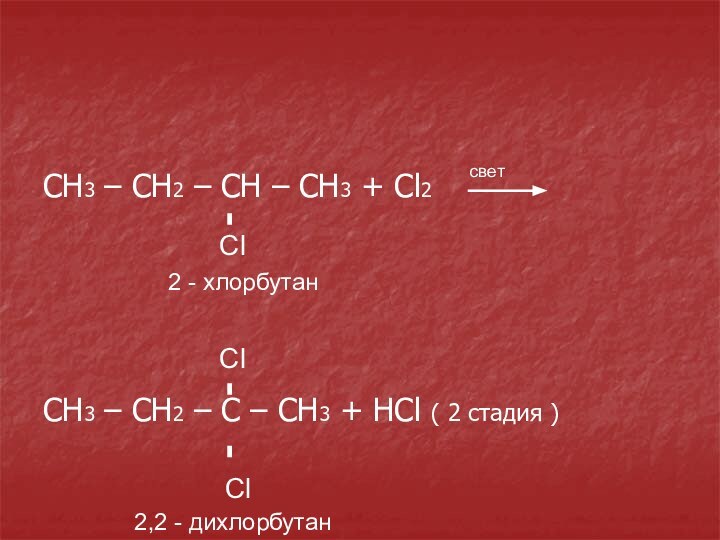
Сl
2 - хлорбутан
Cl
Cl
Cl
свет
2,2 - дихлорбутан
2 - хлорбутан
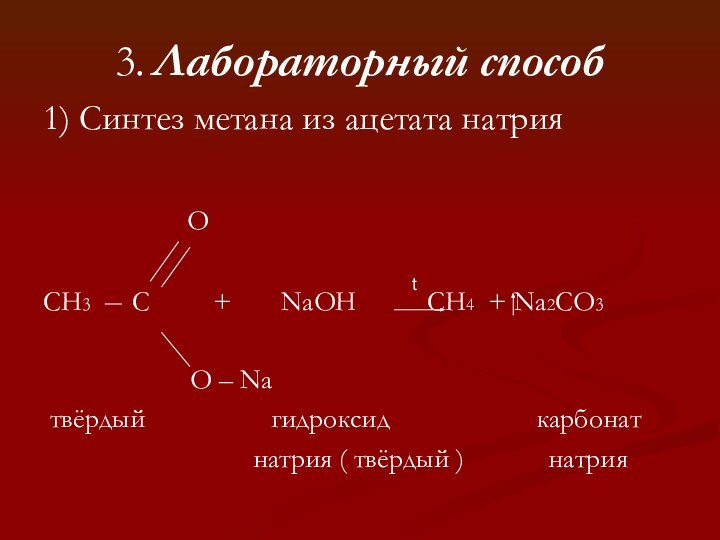
t
азотная кислота
нитрометан
t
t
гексадекан
октан
бутан
бутен
октен
t; P
t
t