- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Термодинамическое равновесие
Содержание
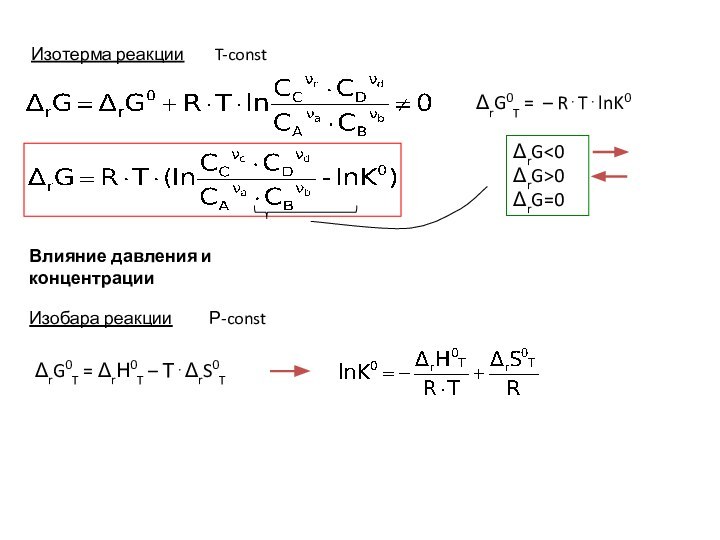
- 2. Изобара реакции Р-constΔrG0T = ΔrН0T – Т⋅ΔrS0TВлияние давления и концентрации
- 3. Сдвиг равновесияИзобара реакции Р-constΔrН00 – K(T) возрастающая функцияПринцип
- 4. Химическое равновесиеТермодинамические параметры: T; P; νi; Сi
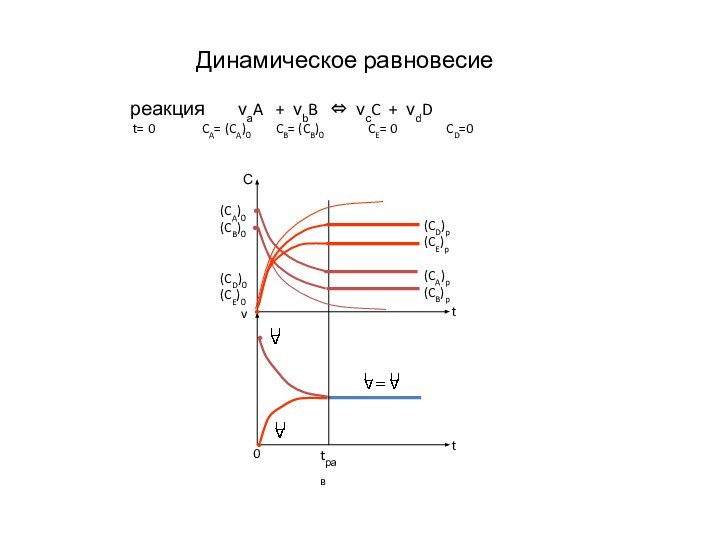
- 5. Динамическое равновесиереакция νаA + νbB
- 6. Константа равновесияKX - концентрации задаются мольными долями
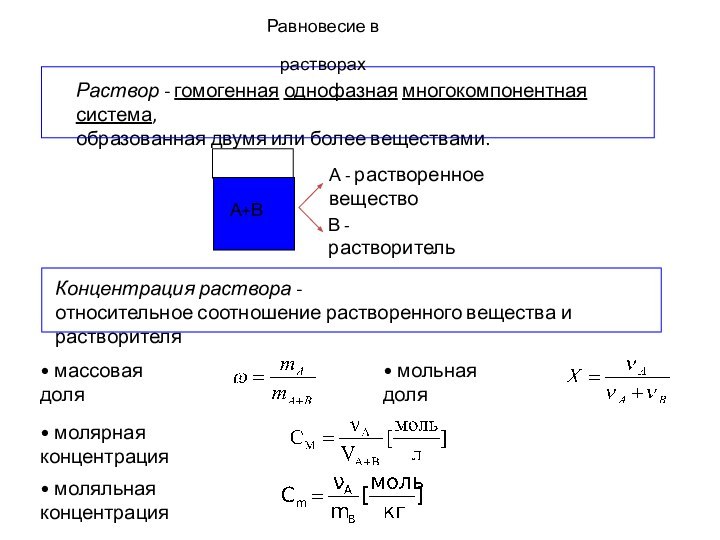
- 7. Равновесие в растворах
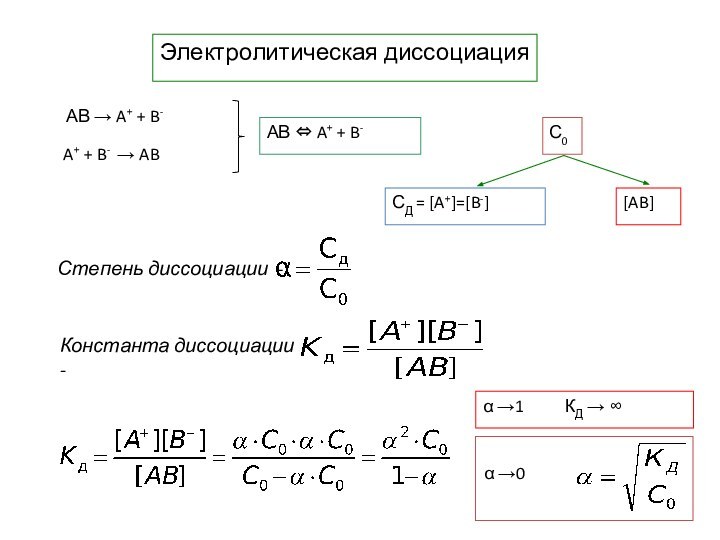
- 8. Электролитическая диссоциацияС0α →1 КД → ∞
- 10. Диссоциация водыH2O ⇔ H+ + OH-Нейтральная среда
- 11. Водородный показательpH = –lg[H+]Нейтральная среда pH
- 12. Произведение растворимости[Kat+]= x·C [моль/л] [An-]= y·C [моль/л]
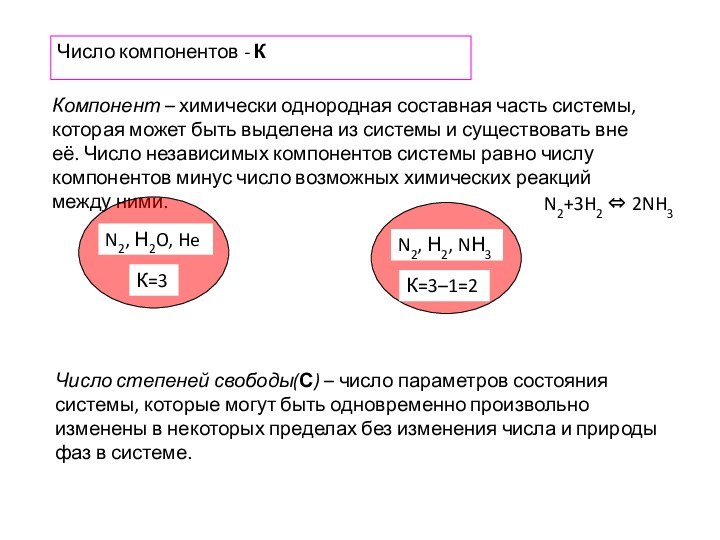
- 13. Число компонентов - К Компонент – химически
- 14. Число степеней свободы равновесной термодинамической системы С
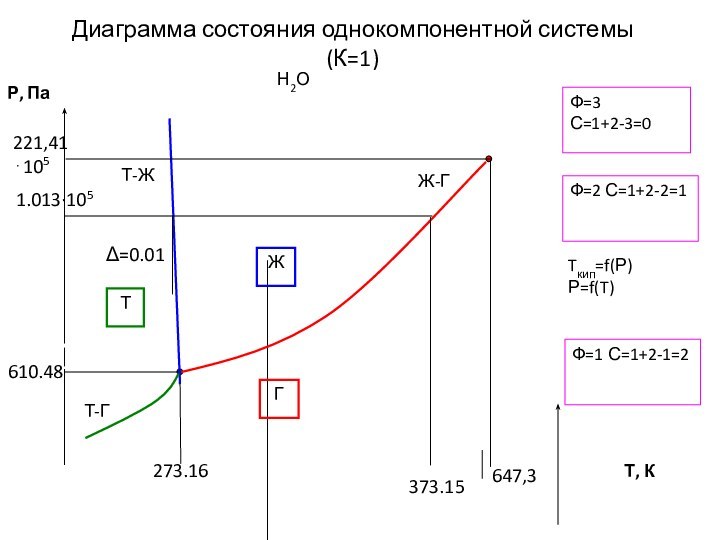
- 15. Диаграмма состояния однокомпонентной системы (К=1)Н2ОФ=2 С=1+2-2=1Ф=3С=1+2-3=0Ф=1 С=1+2-1=2ЖГ ТTкип=f(Р) Р=f(T)
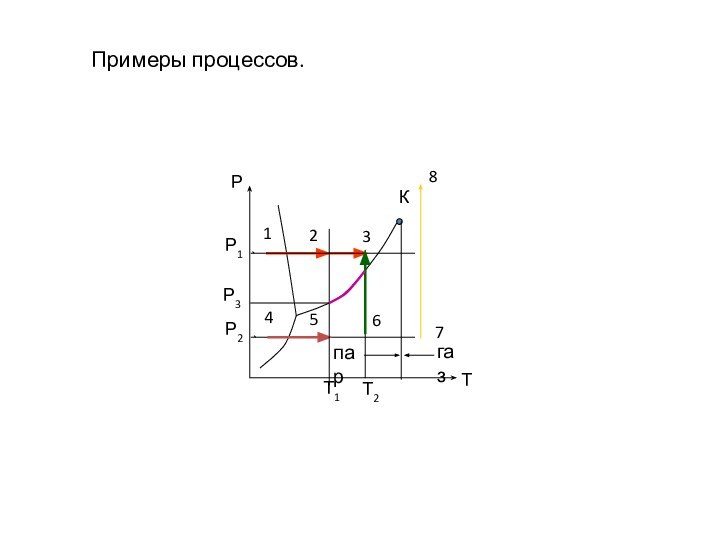
- 16. Примеры процессов.
- 17. Двухкомпонентная система (К=2)α→0Двухфазное равновесие С = 2
- 18. Диаграмма состояния К=2СА
- 19. Кипение и кристаллизация растворов Повышение температуры кипения
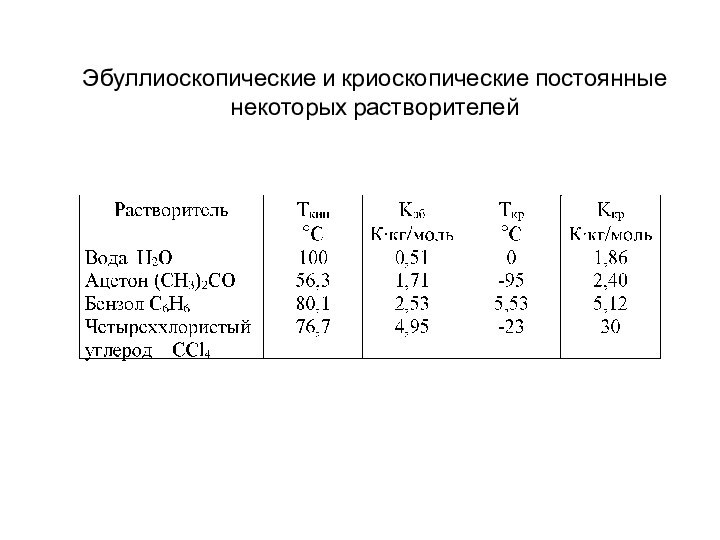
- 20. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 21. Скачать презентацию
- 22. Похожие презентации




![Термодинамическое равновесие Диссоциация водыH2O ⇔ H+ + OH-Нейтральная среда [H+] = [OH–] =](/img/tmb/15/1432540/470c010fe9b7ff70c202de07204a5f91-720x.jpg)
![Термодинамическое равновесие Водородный показательpH = –lg[H+]Нейтральная среда pH = 7Кислая среда](/img/tmb/15/1432540/580f5b8d7a16affb104402870a28d6ca-720x.jpg)
![Термодинамическое равновесие Произведение растворимости[Kat+]= x·C [моль/л] [An-]= y·C [моль/л]](/img/tmb/15/1432540/efefce5d1be380697e8a630a8878c66e-720x.jpg)



Слайд 3
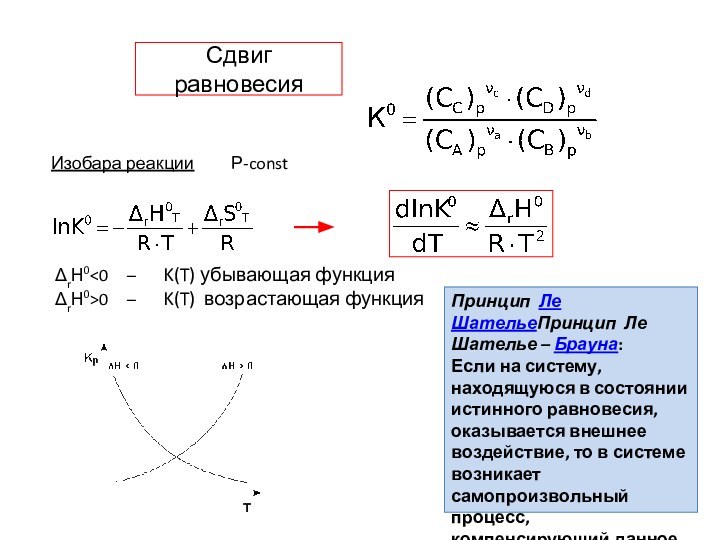
Сдвиг равновесия
Изобара реакции Р-const
ΔrН00 – K(T)
возрастающая функция
Принцип Ле ШательеПринцип Ле Шателье – Брауна:
Если на
систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Слайд 4
Химическое равновесие
Термодинамические параметры: T; P; νi; Сi –
const
1. Термодинамическое условие равновесия - ΔrG = 0
реакция
νаA + νbB ⇔ νсC + νdD
Слайд 6
Константа равновесия
KX - концентрации задаются мольными долями (безразмерная
величина)
Kp - концентрации задаются парциальными давлениями - (Па)Δν
Δν =
(νc+ νd) - (νa+ νb)KC – концентрации задаются молярной концентрацией - (моль/л)Δν
Слайд 10
Диссоциация воды
H2O ⇔ H+ + OH-
Нейтральная среда
[H+] = [OH–] = 10-7 [моль/л]
Кислая среда
[H+] > 10-7 [OH–] <10-7 [моль/л]Щелочная среда [H+] < 10-7 [OH–] > 10-7 [моль/л]
Слайд 11
Водородный показатель
pH = –lg[H+]
Нейтральная среда pH =
7
Кислая среда pH
7Щелочная среда pH > 7
pОH = –lg[ОH–]
pH + pОH = 14
Слайд 13
Число компонентов - К
Компонент – химически однородная
составная часть системы, которая может быть выделена из системы
и существовать вне её. Число независимых компонентов системы равно числу компонентов минус число возможных химических реакций между ними.К=3
К=3–1=2
N2+3H2 ⇔ 2NH3
Число степеней свободы(С) – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе.
Слайд 14 Число степеней свободы равновесной термодинамической системы С равно
числу независимых компонентов системы К минус число фаз Ф
плюс число внешних факторов, влияющих на равновесие.Правило фаз Гиббса - С = К – Ф + 2
Системы: ( по числу компонентов ) одно-, двухкомпонентные и т.д.
(по числу степеней свободы) инвариантные, моно-, дивариантные и т.д.
графическая зависимость состояния системы от внешних условий – диаграммы состояния
Слайд 15
Диаграмма состояния однокомпонентной системы (К=1)
Н2О
Ф=2 С=1+2-2=1
Ф=3
С=1+2-3=0
Ф=1 С=1+2-1=2
Ж
Г
Т
Tкип=f(Р) Р=f(T)
Слайд 17
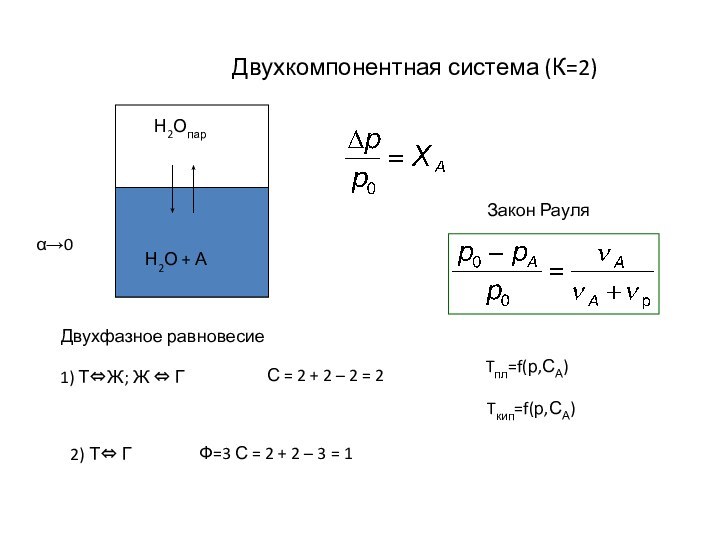
Двухкомпонентная система (К=2)
α→0
Двухфазное равновесие
С = 2 +
2 – 2 = 2
1) Т⇔Ж; Ж ⇔ Г
2) Т⇔ Г
Ф=3 С = 2 + 2 – 3 = 1
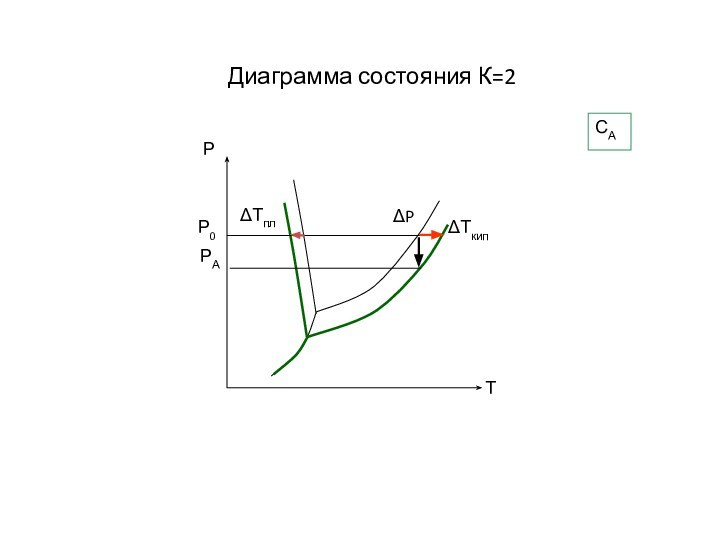
Слайд 19
Кипение и кристаллизация растворов
Повышение температуры кипения раствора
по сравнению с чистым растворителем (ΔТкип) прямо пропорционально концентрации
растворенного веществаСм [моль/кг] – моляльная концентрация
Kэб [К⋅кг/моль]– эбуллиоскопическая постоянная растворителя
Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества
Kкр [К⋅кг/моль]– криоскопическая постоянная растворителя
ΔТкип = Kэб⋅См
ΔТкр = Kкр⋅См





























