- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алканы: физические и химические свойства, получение
Содержание
- 2. Внимание! Задания по типу «ЕГЭ»
- 3. Внимание! Задания по типу «ЕГЭ»Задача 1. Неизвестный
- 4. Для того, чтобы решить заданияВспомним физические свойства
- 5. 1. Физические свойства алкановАлканы (предельные, насыщенные углеводороды)
- 6. Понятие о гомологии и изомерииГомологи – вещества,
- 7. 2. Получение алкановПолучение в промышленности1. Получение из
- 8. 2. Получение алканов (а)Получение в лаборатории1. Разложение
- 9. 2. Получение алканов (б)Получение в лаборатории4. Каталитическое
- 10. 2. Получение алканов (в)Получение в лаборатории7. Восстановление производных алканов8. Получение алканов разветвленного строения (реакция изомеризации)
- 11. 3. Химические свойства (а)В данной презентации рассматриваются
- 12. Галогенирование А) Наибольшее практическое значение имеет хлорирование
- 13. Галогенирование (механизм)
- 14. Нитрование А) Впервые реакцию нитрования алканов провел
- 15. Отщепление водорода (дегидрирование) А) Процесс протекает в
- 16. Окисление алканов (горение) -3
- 17. Окисление алканов (горение) -3
- 18. Цепочка №1 (генетическая связь)
- 19. Цепочка №2 (генетическая связь) Спиртовой р-р
- 20. Цепочка №3 (генетическая связь)
- 21. Решение задачи Ответ: СxHy – метилпропан (С4Н10)
- 22. Спасибо за внимание!Материал тренировочной презентации НЕ
- 23. Скачать презентацию
- 24. Похожие презентации




















Слайд 4
Для того, чтобы решить задания
Вспомним физические свойства алканов.
Повторим
химические свойства алканов.
Проанализируем способы получения алканов (в промышленности и
лаборатории).Выполним тестовые задания по теме «Алканы».
Рассмотрим алгоритмы решения ряда задач по органической химии на определение формулы органического соединения.
Слайд 5
1. Физические свойства алканов
Алканы (предельные, насыщенные углеводороды) –
углеводороды с открытой углеродной цепью, в молекулах которых все
химические связи одинарные (сигма связи).Атомы углерода (С) – в состоянии sp3-гибридизации.
Алканы называют парафинами (от лат. parum affinis – «малое сродство», т.е. с намёком на их низкую химическую активность).
Общая молекулярная формула класса «Алканы» - CnH2n + 2.
Алканы – практически неполярные вещества, не растворяются в воде и других полярных растворителях. Первые четыре представителя гомологического ряда (СН4, С2Н6, С3Н8, С4Н10) – газы без цвета и запаха. Метан легче воздуха, горюч.
Алканы с числом атомов углерода 5-17 – жидкости с характерным «бензиновым» запахом; алканы с числом атомов углерода больше 17 – твердые вещества. Температура кипения и плавления алканов возрастает с ростом молекулярной массы.
Слайд 6
Понятие о гомологии и изомерии
Гомологи – вещества, сходные
по строению и свойствам, отличающиеся на гомологическую разность (СН2
– группу).Пример: СН4, С2Н6
Изомеры – вещества, которые имеют одинаковый качественный и количественный состав, но отличаются по строению.
Слайд 7
2. Получение алканов
Получение в промышленности
1. Получение из природного
сырья (нефти, природных и попутных газов).
2. Крекинг алканов (каталитический
или термический).3. Процесс Фишера-Тропша (синтез при определенных условиях на основе синтез-газа). В ходе реакции образуется смесь алканов!
Слайд 8
2. Получение алканов (а)
Получение в лаборатории
1. Разложение карбида
алюминия (получение метана)
2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
3.
Электролиз солей карбоновых кислот (реакция Кольбе)12
Слайд 9
2. Получение алканов (б)
Получение в лаборатории
4. Каталитическое гидрирование
(присоединение водорода)
5. Реакция Вюрца (алканы с четным числом атомов
углерода)6. Синтез на основе реактива Гриньяра (алканы с нечетным числом атомов углерода)
Слайд 10
2. Получение алканов (в)
Получение в лаборатории
7. Восстановление производных
алканов
8. Получение алканов разветвленного строения (реакция изомеризации)
Слайд 11
3. Химические свойства (а)
В данной презентации рассматриваются только
те свойства,
которые выделены красным цветом. На примере реакции
горения поясняются окислительно-восстановительные реакции в органической химии.
Слайд 12
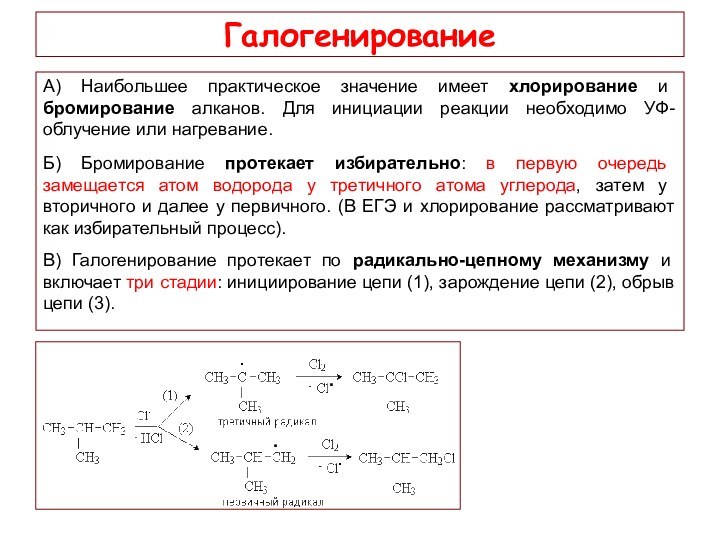
Галогенирование
А) Наибольшее практическое значение имеет хлорирование и
бромирование алканов. Для инициации реакции необходимо УФ-облучение или нагревание.
Б) Бромирование протекает избирательно: в первую очередь замещается атом водорода у третичного атома углерода, затем у вторичного и далее у первичного. (В ЕГЭ и хлорирование рассматривают как избирательный процесс).
В) Галогенирование протекает по радикально-цепному механизму и включает три стадии: инициирование цепи (1), зарождение цепи (2), обрыв цепи (3).
Слайд 14
Нитрование
А) Впервые реакцию нитрования алканов провел М.И.
Коновалов в 1888 г, действуя на алканы разбавленной (12-14%)
азотной кислотой при нагревании, t = 140 0С.Б) Реакция нитрования, как и галогенирования, протекает по радикальному механизму. Предпочтительно замещается атом водорода сначала при третичном атоме углерода, затем вторичном и первичном.
В) В промышленности различают парофазное и жидкофазное нитрование.
Слайд 15
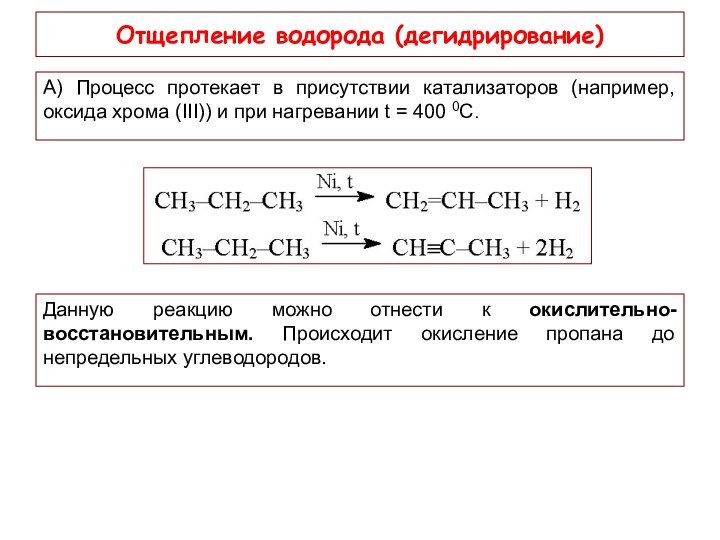
Отщепление водорода (дегидрирование)
А) Процесс протекает в присутствии
катализаторов (например, оксида хрома (III)) и при нагревании t
= 400 0С.Данную реакцию можно отнести к окислительно-восстановительным. Происходит окисление пропана до непредельных углеводородов.
Слайд 16
Окисление алканов (горение)
-3
0
+4 -22С2Н6 + 7О2 = 4СО2 + 6Н2О
-3 +4
2С - 14ē = 2С 2 вос-тель
0 -2 28
О2 + 4ē = 2О 7 ок-тель
С2Н6 – является восстановителем за счет (С-3),
О2 – является окислителем.
Слайд 17
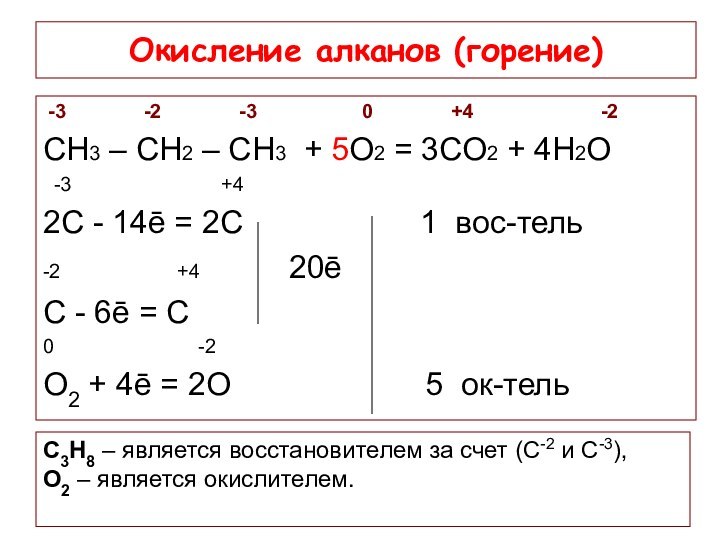
Окисление алканов (горение)
-3
-2
-3 0 +4 -2СН3 – СН2 – СН3 + 5О2 = 3СО2 + 4Н2О
-3 +4
2С - 14ē = 2С 1 вос-тель
-2 +4 20ē
С - 6ē = С
0 -2
О2 + 4ē = 2О 5 ок-тель
С3Н8 – является восстановителем за счет (С-2 и С-3),
О2 – является окислителем.