- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Исходная презентация Подгруппа азота для подготовки урока химии на повышенном уровне
Содержание
- 2. Элементы 15 группыN – азот, P –
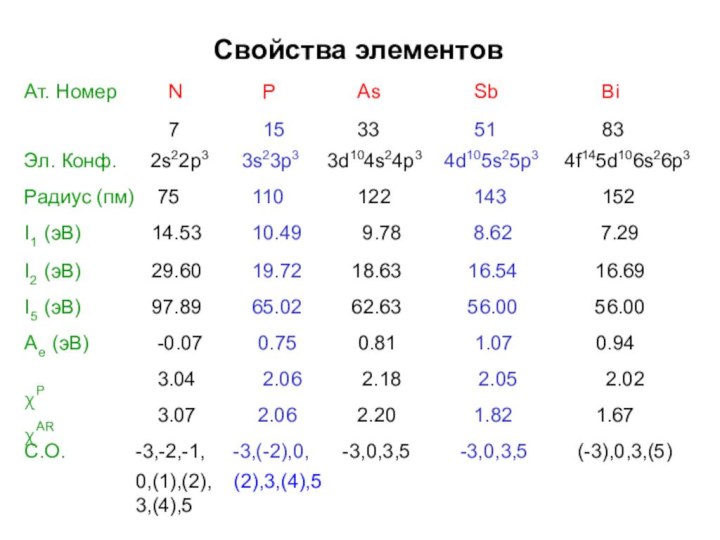
- 3. Свойства элементов
- 4. Свойства простых веществNТ.пл. (оС) -210Т.кип. (оС) -195.8P44257As615(субл)―Sb6301634Bi2721564Гитторфа(аморф)(аморф)N≡N 946P≡P 490
- 5. Реакции молекулярного азота1. С металлами при нагревании3Mg
- 6. Получение и применение азотаАзот составляет 78% воздуха
- 7. Белый фосфорАллотропия фосфораЭлементы могут существовать в более,
- 8. Свойства аллотропов фосфора
- 9. Свойства аллотропов фосфора1. Р4 – термодинамически стандартное
- 10. Свойства аллотропов фосфора4. Белый фосфор очень реакционноспособенP4
- 11. Получение и применение фосфораОсновные минералы фосфора:Ca3(PO4)2 фосфорит,
- 12. Строение As, Sb, Bid1Фрагмент кристаллической структуры серого мышьякаd2Чем меньше d2/d1,тем больше стремление к металлическим свойствам
- 13. Свойства As, Sb, Bi1. Горение на воздухе4As
- 14. Получение и применение As, Sb, BiСульфидные минералы:As4S4
- 15. Строение ЭН3Только в NH3 существенна гибридизация 2s
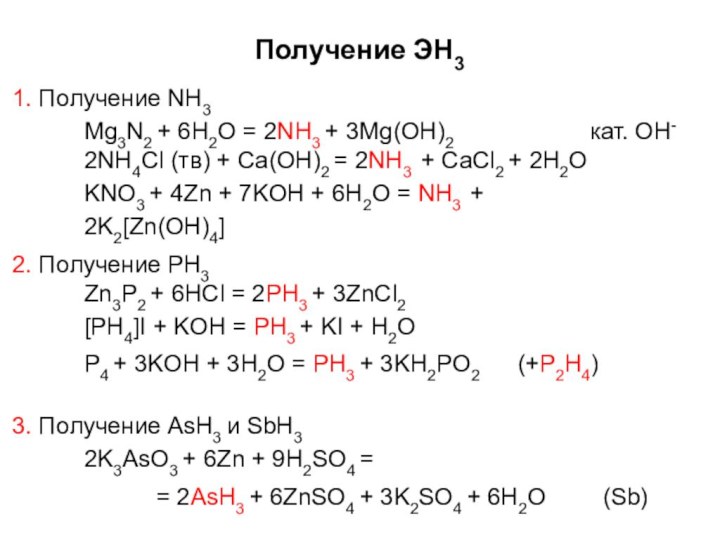
- 16. Получение ЭН31. Получение NH3Mg3N2 + 6H2O =
- 17. Свойства ЭН31. Основания+ -NH3 + H2O ⇔ NH4 +
- 18. Получение и окисление аммиака1. Процесс Боша-ХабераN2 +
- 19. Жидкий аммиак1. Аммиак – жидкость между -77.8оС
- 20. Жидкий аммиак3. Реакции в жидком аммиаке:А)2AgCl +
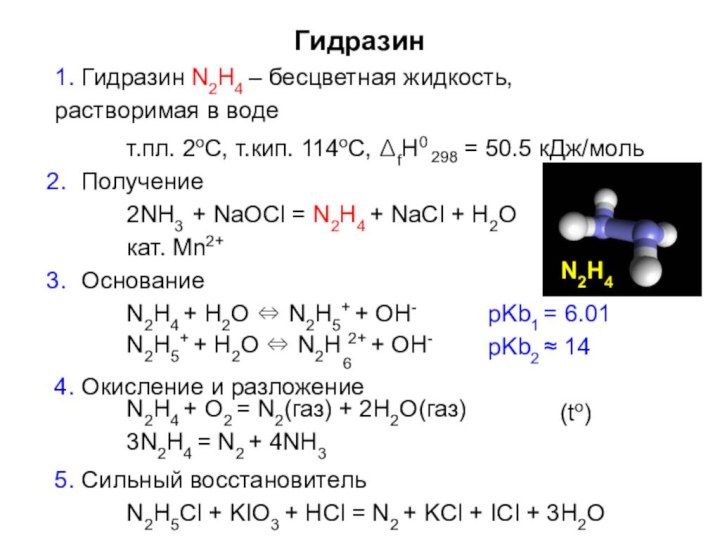
- 21. Гидразин1. Гидразин N2H4 – бесцветная жидкость, растворимая
- 22. ГидроксиламинГидроксиламин NH2OH – бесцветные кристаллы,растворимые в воде
- 23. Сравнение силы основанийNH3N2H4NH2OHУвеличение локализации e-плотности на атоме азотаВозрастание способности присоединить H+Увеличение силы основания
- 24. Азотистоводородная кислота1. Азотистоводородная кислота HN3 (бесцветная жидкость)т.пл.
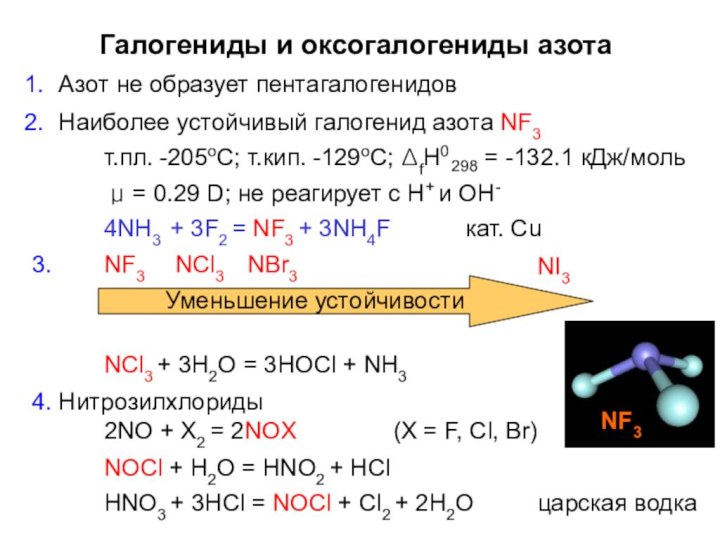
- 25. Галогениды и оксогалогениды азотаАзот не образует пентагалогенидовНаиболее
- 26. Галогениды P, As, Sb, BiP2F4 PF3 PF5AsF3
- 27. Свойства галогенидов P(V)PF5Т.пл. -93.7оСТ.кип. -84.6оС Бесцв. газ[PF5]PCl5
- 28. Кислота HPF61. Гексафторофосфорная кислота HPF6существует только в
- 29. Оксохлорид фосфораОксохорид фосфора POCl3 – бесцветная жидкость
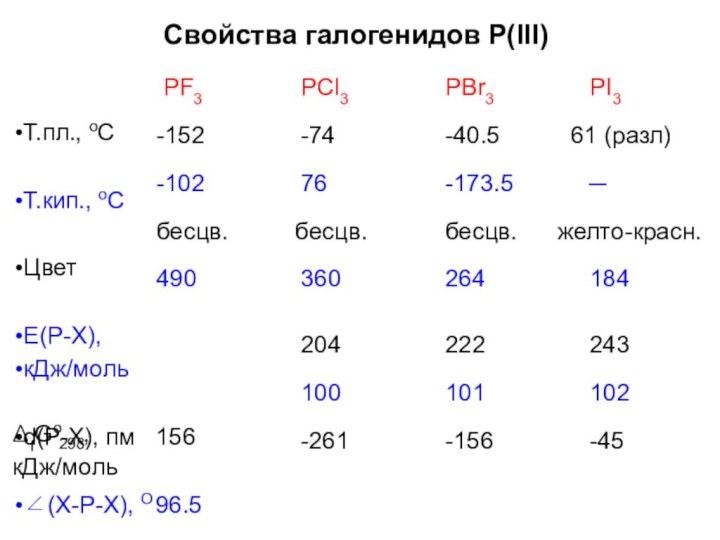
- 30. Свойства галогенидов P(III)PF3-152-102бесцв.490PCl3-7476бесцв.360PBr3-40.5-173.5бесцв.264PI361 (разл)─желто-красн.184Т.пл., оСТ.кип., оСЦветЕ(Р-Х),кДж/мольd(P-X), пм 156∠(Х-Р-Х), О 96.5-936204100-261222101-156243102-45ΔfGo ,298кДж/моль
- 31. PF3 – очень сильный яд, не взаимодействует
- 32. Свойства галогенидов As, Sb, Bi1. Все галогениды,
- 33. Оксиды азота
- 34. Оксиды азота1. Закись азота, оксид азота (I)
- 35. Оксиды азота3. NO – молекула-радикалd(N-O) = 115
- 36. Оксиды азота6. Азотистый ангидрид, оксид азота (III)
- 37. Оксиды азота8. Димеризация NO29. Азотный ангидрид, оксид
- 38. Кислородные кислоты азотаH2N2O2азотноватистаяN+1HNO2азотистаяN+3HNO3азотнаяN+5Увеличение силы кислот
- 39. Кислородные кислоты азота1. Свойства H2N2O2H2N2O2 = H2O+
- 40. Азотная кислотаБезводная HNO3 медленно разлагается при н.у.4HNO3
- 41. Азотная кислота5. Получение HNO34NH3 + 5O2 =
- 42. Red/Ox способность кислот и солей1. В кислой
- 43. Оксиды P, As, Sb, Bi
- 44. Оксиды фосфора1. P2O34P + 3O2 = 2P2O3toP2O3
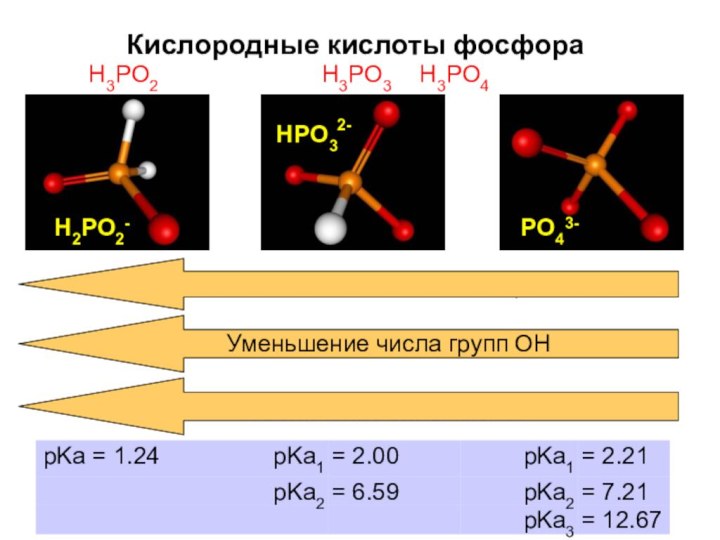
- 45. Кислородные кислоты фосфорафосфорноватистая гипофосфитыфосфористая фосфитыфосфорноватая фосфонатыH3PO4с.о. +5
- 46. Кислородные кислоты фосфораH3PO3 H3PO4HPO3H3PO2PO4Увеличение числа связей Р-Н3-2-H2PO2-Уменьшение числа групп ОНУвеличение силы кислот
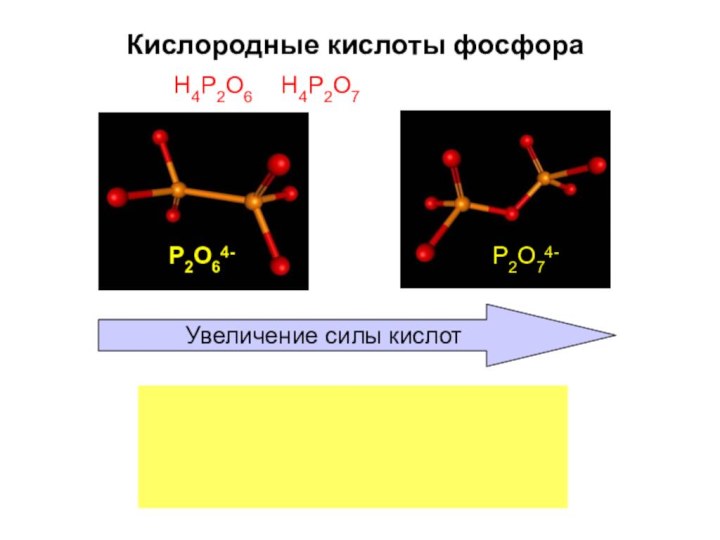
- 47. Кислородные кислоты фосфораH4P2O6 H4P2O7Увеличение силы кислотP2O74-P2O64-
- 48. Кислородные кислоты фосфора1. Фосфорноватистая кислота H3PO2Ba(H2PO2)2 +
- 49. Кислородные кислоты фосфора3. Фосфорноватая кислота H4P2O64NaOCl +
- 50. Кислородные кислоты фосфора5. Фосфорная кислота H3PO4не окислитель,
- 51. Оксиды As, Sb, BiВсе оксиды As, Sb,
- 52. Кислоты/гидроксиды As, Sb, Bi
- 53. H3AsO4 – кислота, Bi(OH)3 – основание, остальные
- 54. Кислоты/гидроксиды As, Sb, Bi4. Для Sb и
- 55. Сравнение кислородных кислотH3PO4H3SbO4H3AsO4Уменьшение силы кислотУсиление окислительной способностиH3PO4 H2SO4HClO4Увеличение силы кислотУсиление окислительной способности
- 56. Скачать презентацию
- 57. Похожие презентации














![Исходная презентация Подгруппа азота для подготовки урока химии на повышенном уровне Свойства ЭН31. Основания+ -NH3 + H2O ⇔ NH4 + OHPH3 + HI = [PH4]INH3 PH3pKb](/img/tmb/7/639661/b9f0ae74130edc7dc91e462dae9f0499-720x.jpg)







![Исходная презентация Подгруппа азота для подготовки урока химии на повышенном уровне Свойства галогенидов P(V)PF5Т.пл. -93.7оСТ.кип. -84.6оС Бесцв. газ[PF5]PCl5 Т.пл. 167оС бесцветноетвердое в-во+ -[PCl4 ][PCl6](/img/tmb/7/639661/0a8a35e44037aad9416ad2a6d24ec95e-720x.jpg)






















Слайд 4
Свойства простых веществ
N
Т.пл. (оС) -210
Т.кип. (оС) -195.8
P
44
257
As
615(субл)
―
Sb
630
1634
Bi
272
1564
Гитторфа
(аморф)
(аморф)
N≡N 946
P≡P 490
Слайд 5
Реакции молекулярного азота
1. С металлами при нагревании
3Mg +N2
= Mg3N2
2Ti + N2 = 2TiN
2Al + N2 =
2AlN2. С Н2 на катализаторе
N2 + 3H2 = 2NH3
450oC
800oC
900oC
(процесс Боша-Габера)
С О2 в электрическом разряде
N2 + O2 = 2NO
С комплексами переходных металлов
[Ru(NH3)5]Cl3 + N2 + Zn/Hg =
= [Ru(NH3)5(N2)]Cl2 + ZnCl2 + Hg + H2O
Слайд 6
Получение и применение азота
Азот составляет 78% воздуха (объем)
или 76% (масса)
Промышленное получение азота:
фракционирование воздуха или
разделение воздуха на
мембранахПолучение азота в лаборатории:
2NaN3 = 2Na + 3N2 NH4NO2 = N2 + 2H2O
4. Основное применение:
(to)
(to)
создание инертной атмосферы
синтез аммиака
охлаждение
Слайд 7
Белый фосфор
Аллотропия фосфора
Элементы могут существовать в более, чем
одной форме, которые называются аллотропными модификациями и имеют разные
физические и химические свойстваФосфор Гитторфа
(фиолетовый)
Сложная слоистая структура: Р7 и Р8, «сшитые» в слои
Красный фосфор неупорядоченный вариант фосфора Гитторфа
Черный фосфор
Фосфор высокого давления
(кубический)
d(P-P) = 219-223 пм
Слайд 9
Свойства аллотропов фосфора
1. Р4 – термодинамически стандартное состояние
(по
определению)
Рчерный
1/4Р4
Ркрасный
-39.3
кДж/моль
-17.6
кДж/моль
Черный фосфор химически инертен
Красный фосфор окисляется в разных условиях
2P
+ 5Cl2 = 2PCl5 (+ PCl3)2P + 5CuSO4 + 8H2O = 5Cu + 2H3PO4 + 5H2SO4
6P + 5KClO3 = 3P2O5 + 5KCl
механоактивация
Слайд 10
Свойства аллотропов фосфора
4. Белый фосфор очень реакционноспособен
P4 +
5O2 = 2P2O5
самовозгорание
P4 + 3NaOH + 3H2O = PH3
+ 3NaH2PO2P4 + 20HNO3 (конц) = 4H3PO4 +20NO2 + 4H2O
4P4 + 2Na = Na2P16 P4 + Na = Na3P7
в растворе ДМФ в диглиме
Слайд 11
Получение и применение фосфора
Основные минералы фосфора:
Ca3(PO4)2 фосфорит, Ca5(PO4)3(OH,F)
апатит
Апатиты
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + 10CO
+ P41400oC
Важнейшие статьи применения:
фосфорные удобрения
пищевая промышленность
химический синтез (H3PO4, P2O5, PCl3)
Слайд 12
Строение As, Sb, Bi
d1
Фрагмент кристаллической структуры серого мышьяка
d2
Чем
меньше d2/d1,
тем больше стремление к металлическим свойствам
Слайд 13
Свойства As, Sb, Bi
1. Горение на воздухе
4As +
3O2 = 2As2O3
2Sb + 2O2 = Sb2O4
(Bi)
[SbIIISbVO4]
Реакции с кислотами-окислителями
As
+ 5HNO3 (конц) = H3AsO4 + 5NO2 + H2O Bi + 4HNO3 = Bi(NO3)3 + NO + 2H2OРеакции с галогенами
(Sb)
2As + 5F2 = 2AsF5
2Bi + 3Cl2 = 2BiCl3
4. Реакция Марша (только As)
(Sb)
2As + 5NaOCl + 6NaOH = 2Na3AsO4 + 5NaCl + 3H2O
Слайд 14
Получение и применение As, Sb, Bi
Сульфидные минералы:
As4S4 реальгар,
FeAsS арсенопирит, Sb2S3 сурьмяный блеск,
Bi2S3 висмутовый блеск, Bi2Te2S тетрадимит
1.
Обжиг сульфидовВосстановление
As2O3 + 3C = 2As + 3CO Sb2O4 + 4C = 2Sb + 4CO
Применение
инсектициды, полупроводники (As)
в электронной технике (Sb, Sb2S3)
(to)
(Bi)
в легкоплавких сплавах (Bi), в катализаторах, красителях (Bi2O3)
Слайд 15
Строение ЭН3
Только в NH3 существенна гибридизация 2s и
2р орбиталей; в PH3, AsH3, SbH3 – связь между
орбиталями np(Pn) и 1s(Н)
Слайд 16
Получение ЭН3
1. Получение NH3
Mg3N2 + 6H2O = 2NH3
+ 3Mg(OH)2
кат. OH-
2NH4Cl (тв) + Ca(OH)2 = 2NH3 +
CaCl2 + 2H2O KNO3 + 4Zn + 7KOH + 6H2O = NH3 + 2K2[Zn(OH)4]2. Получение PH3
Zn3P2 + 6HCl = 2PH3 + 3ZnCl2 [PH4]I + KOH = PH3 + KI + H2O
P4 + 3KOH + 3H2O = PH3 + 3KH2PO2
(+P2H4)
3. Получение AsH3 и SbH3 2K3AsO3 + 6Zn + 9H2SO4 =
= 2AsH3 + 6ZnSO4 + 3K2SO4 + 6H2O
(Sb)
Слайд 17
Свойства ЭН3
1. Основания
+ -
NH3 + H2O ⇔ NH4 + OH
PH3
+ HI = [PH4]I
NH3 PH3
pKb = 4.75
AsH3
SbH3
Возрастание силы основания
2. Кислоты
2Li
+ 2PH3 = 2LiPH2 + H22K + 2NH3 = 2KNH2 + H2
(в ТГФ)
3. Окисление
PH3 + O2 = HPO3 + H2O
(без горения!)
PH3
Слайд 18
Получение и окисление аммиака
1. Процесс Боша-Хабера
N2 + 3H2
⇔ 2NH3 ΔfH0
298
= -92 кДж/моль
= -33 Дж/моль/К
ΔfS0
298
ΔrS0 < 0 !
Требования:
оптимальный баланс скорость/выход Условия:Р = 200 атм
Т = 450 оС;
кат. Fe3O4 + Al2O3 + K2O + SO2
увеличение скорости
увеличение выхода
2. Направления окисления NH3
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
2NH3 + 2O2 = NH4NO3 + H2O
кат. Rh/Pt (быстро)
без кат.
кат. Rh/Pt (медленно)
Выбор условий: поток газов через катализатор
Слайд 19
Жидкий аммиак
1. Аммиак – жидкость между -77.8оС и
-33.4оС
(ΔТ = 44.4 К)
2NH3 ⇔ NH + + NH
- pK = 26.3; ε = 25.04 2 am
Меньшая способность растворять ионные соединения в
случае отсутствия ионного взаимодействия, чем у воды
K
K+solv + e-
solv
электропроводность!
4K + 9Ge
K4Ge9·en
соли Цинтля
2. Растворение щелочных металлов
NH3 (ж)
NH3 (ж)
en
Слайд 20
Жидкий аммиак
3. Реакции в жидком аммиаке:
А)
2AgCl + Ba(NO3)2
= 2AgNO3 + 2BaCl2↓
обмен
NH4Br + KNH2 = 2NH3 +
KBr↓нейтрализация
3NH4Br + Na3As = AsH3 + 3NaBr + 3NH3
кислота
2KNH2 + Zn(NO3)2 = 2KNO3 + Zn(NH2)2
основание
Zn(NO3)2 + 4KNH2 = K2[Zn(NH2)4] + 2KNO3
комплекс
Б)
В)
Г)
Д)
Слайд 21
Гидразин
1. Гидразин N2H4 – бесцветная жидкость, растворимая в
воде
т.пл. 2оС, т.кип. 114оС, ΔfH0
298
= 50.5 кДж/моль
Получение
2NH3 + NaOCl
= N2H4 + NaCl + H2Oкат. Mn2+
Основание
N2H4 + H2O ⇔ N2H5+ + OH-
pKb1 = 6.01
pKb2 ≈ 14
N2H5+ + H2O ⇔ N2H 2+ + OH-
6
4. Окисление и разложение
N2H4 + O2 = N2(газ) + 2H2O(газ) 3N2H4 = N2 + 4NH3
5. Сильный восстановитель
(to)
N2H5Cl + KIO3 + HCl = N2 + KCl + ICl + 3H2O
N2H4
Слайд 22
Гидроксиламин
Гидроксиламин NH2OH – бесцветные кристаллы,
растворимые в воде т.пл.
33оС
Получение
6H+ + HNO3 + 6e- = NH2OH + 2H2O
3.
Основаниеэлектролиз
NH2OH + H2O ⇔ NH3OH+ + OH-
Разложение
3NH2OH = NH3 + N2 + 3H2O
Восстановитель
2NH2OH + I2 = N2 + 2HI + 2H2O
Окислитель
pKb = 7.18
[NH3OH]Cl + FeCl2 + 2HCl = NH4Cl + FeCl3 + H2O
NH OH
2
Слайд 23
Сравнение силы оснований
NH3
N2H4
NH2OH
Увеличение локализации e-плотности на атоме азота
Возрастание
способности присоединить H+
Увеличение силы основания
Слайд 24
Азотистоводородная кислота
1. Азотистоводородная кислота HN3 (бесцветная жидкость)
т.пл. -80оС;
т.кип. 36оС; ΔfH0
298
= 265 кДж/моль
Слабая кислота
HN3 ⇔ H+ +
N3Окислитель
Cu + 3HN3 = Cu(N3)2 + N2 + NH3
Получение
–
pKa = 4.76
2NaNH2 + N2O = NaN3 + NaOH + NH3
2NaN3 + H2SO4 = Na2SO4 + 2HN3↑
200oC
N3
-
N3
–
симметричный анион, d(N-N) = 116 пм
Слайд 25
Галогениды и оксогалогениды азота
Азот не образует пентагалогенидов
Наиболее устойчивый
галогенид азота NF3
т.пл. -205оС; т.кип. -129оС; ΔfH0
298
= -132.1 кДж/моль
μ
= 0.29 D; не реагирует с Н+ и ОН-4NH3 + 3F2 = NF3 + 3NH4F
кат. Cu
NI3
3.
NF3 NCl3 NBr3
Уменьшение устойчивости
NCl3 + 3H2O = 3HOCl + NH3
4. Нитрозилхлориды
2NO + X2 = 2NOX
NOCl + H2O = HNO2 + HCl
(X = F, Cl, Br)
HNO3 + 3HCl = NOCl + Cl2 + 2H2O
царская водка
NF3
Слайд 26
Галогениды P, As, Sb, Bi
P2F4 PF3 PF5
AsF3 AsF5
SbF3
SbF5
BiF3 BiF5
P2Cl4 PCl3 PCl5
AsCl3 AsCl5
SbCl3 SbCl5
BiCl3
P2Br4 PBr3 PBr5
Bi4Br4 BiBr3
AsBr3
SbBr3
SbBr5P2I4 PI3 PI5 (?)
Bi4I4 BiI3
AsI3
SbI3
Слайд 27
Свойства галогенидов P(V)
PF5
Т.пл. -93.7оС
Т.кип. -84.6оС Бесцв. газ
[PF5]
PCl5 Т.пл.
167оС бесцветное
твердое в-во
+ -
[PCl4 ][PCl6 ]
PBr5 PI5
Т.разл. 106оС ? желтое твердое ? вещество ?
+ -
[PBr4
]Br ?Галогенангидриды:
PX5 + 4H2O = H3PO4 + 5HX
PCl5
RCl
(PNCl2)3
POCl3
[PCl4
+][BCl -]
4
KPF6
[PCl4
+][AsF -]
6
KHF2
P2O5
ROH
AsF5 BCl3
NH4Cl
Слайд 28
Кислота HPF6
1. Гексафторофосфорная кислота HPF6
существует только в растворе
HPF6
⇔ H+ + PF6
2. Получение
-
pKa ≈ -10
H3PO4 + 6HF
(конц) = HPF6 + 4H2OНе окислитель, не координирующий ион
Соли гексафторофосфаты растворимы в воде
PF6
-
d(P–F) = 160 пм
Слайд 29
Оксохлорид фосфора
Оксохорид фосфора POCl3 – бесцветная жидкость т.пл.
2оС; т.кип. 105оС
Получение
2PCl3 + O2 = 2POCl3
3PCl3 + P2O5
= 5POCl33. Свойства
POCl3 + 3H2O= H3PO4 + 3HCl
(to)
(to)
гидролиз
POCl3 + 3NaNO2 = 3NOCl + Na3PO4 POCl3 + 4NH3 = PON + 3NH4Cl
POCl
3
d(P–Cl) = 199 пм
d(P=O) = 145 пм
Слайд 30
Свойства галогенидов P(III)
PF3
-152
-102
бесцв.
490
PCl3
-74
76
бесцв.
360
PBr3
-40.5
-173.5
бесцв.
264
PI3
61 (разл)
─
желто-красн.
184
Т.пл., оС
Т.кип., оС
Цвет
Е(Р-Х),
кДж/моль
d(P-X), пм 156
∠(Х-Р-Х), О 96.5
-936
204
100
-261
222
101
-156
243
102
-45
ΔfGo ,
298
кДж/моль
Слайд 31
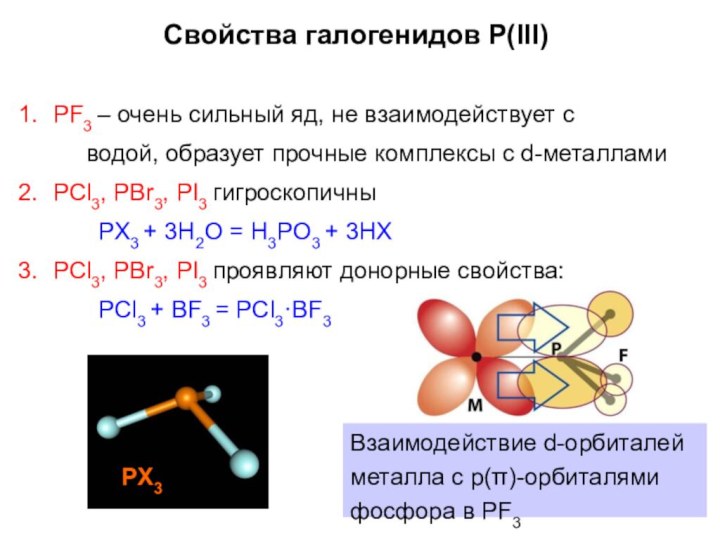
PF3 – очень сильный яд, не взаимодействует с
водой,
образует прочные комплексы с d-металлами
PCl3, PBr3, PI3 гигроскопичны
PX3 +
3H2O = H3PO3 + 3HXPCl3, PBr3, PI3 проявляют донорные свойства:
PCl3 + BF3 = PCl3·BF3
Свойства галогенидов P(III)
Взаимодействие d-орбиталей металла с p(π)-орбиталями фосфора в PF3
PX3
Слайд 32
Свойства галогенидов As, Sb, Bi
1. Все галогениды, кроме
AsF3, SbF3, SbCl3, Bi4Br4, получают
прямым синтезом
As2O3 + 3H2SO4 +
3CaF2 = 3AsF3 + 3CaSO4 + 3H2O4BiBr3 + 8Bi = 3Bi4Br4
в инертной атмосфере
Все галогениды, кроме Bi4Br4, Bi4I4, BiI3, гигроскопичны
SbCl5 + 4H2O = H3SbO4 + 5HCl AsCl3 + 3H2O = H3AsO3 + 3HCl BiCl3 + H2O = BiOCl + 2HCl
Все пентагалогениды – сильные кислоты Льюиса
SbCl5 + AlCl3 = [AlCl2+][SbCl6-]
Bi4I4
Слайд 34
Оксиды азота
1. Закись азота, оксид азота (I) N2O
NH4NO3 = N2O + 2H2O NH2OH + HNO2 =
N2O + 2H2O C + 2N2O = CO2 + 2N2«веселящий газ»
250oC
поддерживает горение
получение
Линейная молекула
d(N-N) = 113 пм
d(N-O) = 119 пм
2. Получение моноксида азота, оксида азота (II) NO
4NH3 + 5O2 = 4NO + 6H2O
1000oC, кат. (пром.)
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2KNO2 + 2KI + 2H2SO4 = 2K2SO4 + I2 +2NO
в лаборатории
N2O
Слайд 35
Оксиды азота
3. NO – молекула-радикал
d(N-O) = 115 пм строение:
1σ2 2σ2 1π4 3σ2 2π1 4σ0 один неспаренный электрон
на разрыхляющей орбитали – нет димеризации !NO- NO NO+
- e-
+ e-
4. NO не растворяется в воде, не реагирует с H+ и OH-
2NO + O2 = 2NO2
2NO + Cl2 = 2NOCl
5. NO – слабый окислитель, слабый восстановитель
2NO + 3Sn + 8HCl = 3SnCl2 + 2[NH3OH]Cl
2NO + K2Cr2O7 + 4H2SO4 = 2HNO3 + Cr2(SO4)3 + K2SO4 + 3H2O
при н.у.
Слайд 36
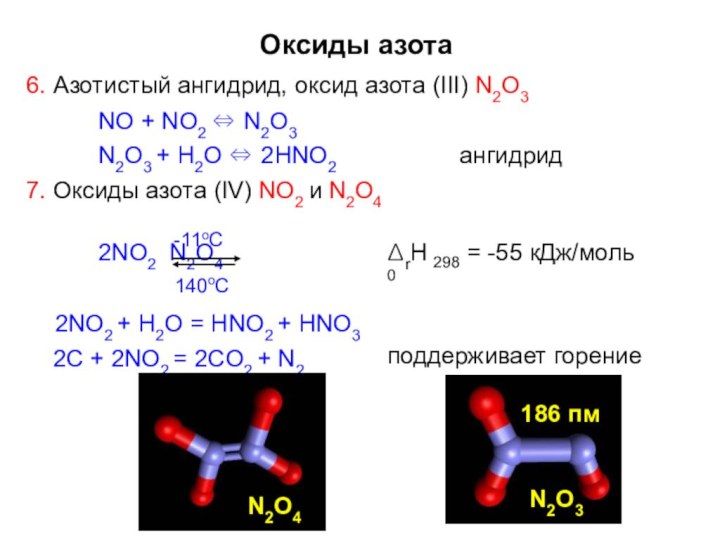
Оксиды азота
6. Азотистый ангидрид, оксид азота (III) N2O3
NO
+ NO2 ⇔ N2O3
N2O3 + H2O ⇔ 2HNO2
7. Оксиды
азота (IV) NO2 и N2O4ангидрид
2NO2 N2O4
ΔrH0
298
= -55 кДж/моль
140oC
2NO2 + H2O = HNO2 + HNO3
2С + 2NO2 = 2CO2 + N2
164 пм
поддерживает горение
N2O3
186 пм
-11oC
N2O4
Слайд 37
Оксиды азота
8. Димеризация NO2
9. Азотный ангидрид, оксид азота
(V) N2O5
2HNO3 + P2O5 = N2O5 + 2HPO3 N2O5
+ I2 = I2O5 + N2получение окислитель
взрывоопасен !
Слайд 38
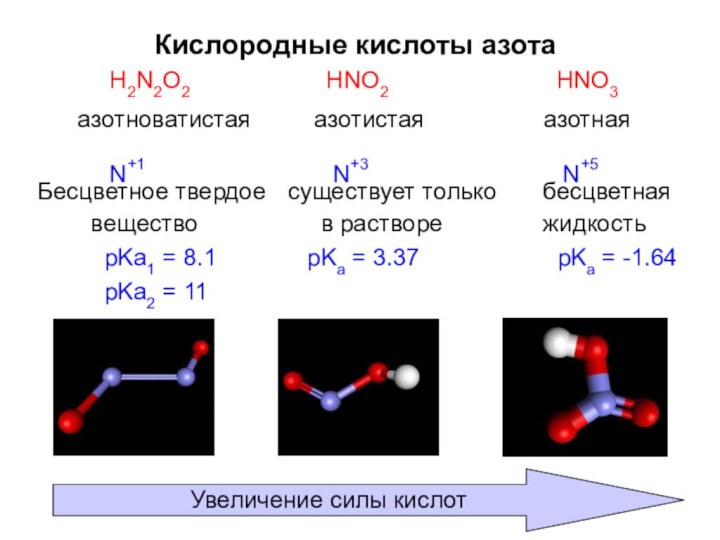
Кислородные кислоты азота
H2N2O2
азотноватистая
N+1
HNO2
азотистая
N+3
HNO3
азотная
N+5
Увеличение силы кислот
Слайд 39
Кислородные кислоты азота
1. Свойства H2N2O2
H2N2O2 = H2O+ N2O
2.
Получение HNO2
неустойчива
Ba(NO2)2 + H2SO4 = 2HNO2 + BaSO4↓ N2O3
+ H2O = 2HNO23HNO2 = 2NO + HNO3 + H2O
3. Red/ox свойства HNO2
медленно
HNO2 + Br2 + H2O = 2HBr + HNO3
E0(NO -/N O) = +0.15 B E0(HNO /N O) = +1.30 B
2 2 2 2
HNO2 + FeCl2 + HCl = FeCl3 + NO + H2O
2HNO2 + 2SnCl2 + 8HCl = 3H2O + 2H2SnCl6 + N2O NaNO2 + 3Zn + 5NaOH + 5H2O = 3Na2[Zn(OH)4] + NH3
Слайд 40
Азотная кислота
Безводная HNO3 медленно разлагается при н.у.
4HNO3 =
4NO2 + 2H2O + O2
Образует азеотроп (68%) с водой
(т.кип.=120.8оС)устойчивый при н.у.
HNO3 реагирует почти со всеми металлами
(кроме Au, Ta, Hf, Re, Pt, Os, Ir, Rh, Ru) 8Fe + 30HNO3 (р) = 8Fe(NO3)3 + 3NH4NO3 + 9H2O Sn + 4HNO3 (к) = SnO2 + 4NO2 + 2H2O
Безводная HNO3 реагирует с неметаллами
(S, Se, Te, I, …)
6S + 6HNO3 (б/в) = H2SO4 + 6NO2 + 2H2O
Концентрированная HNO3 пассивирует некоторые металлы (Al, Cr, Fe, …)
Слайд 41
Азотная кислота
5. Получение HNO3
4NH3 + 5O2 = 4NO
+ 6H2O
2NO + O2 = 2NO2 (2NO2 ⇔ N2O4)
p, to,
кат.2NO2 + H2O = HNO3 + HNO2
2HNO2 = NO + NO2 + H2O
3NO2 + H2O = 2HNO3 + NO
6. Нитраты
растворимы в воде, разлагаются при нагревании
2KNO3 = 2KNO2 + O2
2Cd(NO3)2 = 2CdO + 2NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
to
окислители в кислой среде и в расплаве
MnO2 (тв) + 2KOH (ж) + KNO3 (ж) = K2MnO4 + KNO2 + H2O
Слайд 42
Red/Ox способность кислот и солей
1. В кислой среде
окислительные свойства в положительных с.о. выражены сильнее, чем в
щелочнойE0(NO3 /HNO2) = +0.93B
-
E0(NO3 /NO2 ) = +0.01B
- -
2. В кислой среде восстановительные свойства в отрицательных с.о. выражены слабее, чем в щелочной
E0(N2/N2H5 ) = -0.23B
E0(N2/N2H4) = -1.12B
+
В кислой среде диспропорционируют все с.о. с образованием
N2, HNO3, NH4
В щелочной среде NO и N2O4 сопропорционируют
+
2NO + N2O4 + 4OH- = 4NO2 + 2H2O
-
Слайд 44
Оксиды фосфора
1. P2O3
4P + 3O2 = 2P2O3
to
P2O3 +
3H2O = 2H3PO3
ангидрид
2. P2O5
4P + 5O2 = 2P2O5
P2O5 +
3H2O = 2H3PO4ангидрид
сильнейшее водуотнимающее средство
165 пм
160 пм
140 пм
Слайд 45
Кислородные кислоты фосфора
фосфорноватистая гипофосфиты
фосфористая фосфиты
фосфорноватая фосфонаты
H3PO4
с.о. +5 фосфорная
фосфаты
H4P2O7
с.о. +5 пирофосфорная пирофосфаты
(HPO3)n
[n = 3,4]
H5P3O10
с.о. +5
трифосфорная трифосфаты
с.о. +5
метафосфорная полифосфаты
Слайд 46
Кислородные кислоты фосфора
H3PO3 H3PO4
HPO3
H3PO2
PO4
Увеличение числа связей Р-Н
3-
2-
H2PO2
-
Уменьшение числа групп
ОН
Увеличение силы кислот
Слайд 48
Кислородные кислоты фосфора
1. Фосфорноватистая кислота H3PO2
Ba(H2PO2)2 + H2SO4
= 2H3PO2 + BaSO4↓
получение
2H3PO2 = H3PO4 + PH3 (to)
Сильный восстановитель
H3PO2
+ 4FeCl3 + 2H2O = H3PO4 + 4FeCl2 + 4HClNaH2PO2 + 4AgNO3 + 2H2O = H3PO4 + 4Ag + NaNO3 + 3HNO3
диспропорционирование
2. Фосфористая кислота H3PO3 P2O3 + 3H2O = 2H3PO3 4H3PO3 = 3H3PO4 + PH3 (to)
Восстановитель
диспропорционирование
Na2HPO3 + 2AgNO3 + H2O = H3PO4 + 2Ag + 2NaNO3
(to)
Слайд 49
Кислородные кислоты фосфора
3. Фосфорноватая кислота H4P2O6
4NaOCl + 2P
+ 2NaOH = Na2H2P2O6↓ + 4NaCl
все соли плохо растворимы
!H4P2O6 + H2O = H3PO4 + H3PO3
25oC
4. Пирофосфорая и метафосфорная кислоты H4P2O7, HPO3
2H3PO4
H4P2O7 2HPO3
Na4P2O7 + 4AgNO3 = Ag4P2O7↓+ 4NaNO3
250oC 400oC
-H O
2
-H O
2
Слайд 50
Кислородные кислоты фосфора
5. Фосфорная кислота H3PO4
не окислитель, не
разлагается
E0(H3PO4/H3PO3) = -0.29 B
H2PO4
-
все соли растворимы растворимы только
соли ЩМ,
кроме LiHPO4 PO4
2-
3-
Na3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4↓ Ag3PO4 + 3HNO3 = H3PO4 + 3AgNO3 12(NH4)6Mo7O24 + 51HNO3 + 7H3PO4 =
ПР = 10-20
= 7(NH4)3[PMo12O40]·3H2O + 51NH4NO3 + 15H2O
Слайд 51
Оксиды As, Sb, Bi
Все оксиды As, Sb, Bi
имеют полимерное строение
Все оксиды, кроме As2O5, плохо растворимы в
водеAs2O5 + 3H2O = 2H3AsO4
Все оксиды, кроме Bi2O3, растворимы в щелочах
As2O3 + 6KOH = 2K3AsO3 + 3H2O
Все оксиды, кроме As2O5, растворимы в кислотах
Sb2O3 + 3H2SO4 = Sb2(SO4)3 + 3H2O Sb2O5 + 12HCl = 2H[SbCl6] + 5H2O
As2O5, Sb2O5, Bi2O5 – сильные окислители
Bi2O5 >> Sb2O5 = As2O5 (>> P2O5)
Sb2O5 (тв) + 10HCl (к) = 2SbCl3 + 2Cl2 + 5H2O
Sb2O3
Слайд 53
H3AsO4 – кислота, Bi(OH)3 – основание, остальные амфотерны
H3AsO4,
H3SbO4 – окислители средней силы,
их соли не окислители
E0(H3AsO4/H3AsO3) =
+0.56 B E0(H3SbO4/SbO+) = +0.58 BТолько H3AsO4 можно получить из ангидрида
As2O5 + 3H2O = 2H3AsO4
2SbCl3 + 3Na2CO3 + 3H2O = 2Sb(OH)3 + 6NaCl + 3CO2
Кислоты/гидроксиды As, Sb, Bi





























